题目内容
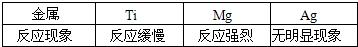
金属活动顺序是按金属活动性由强到弱排列的,元素周期表是按原子序数由小到大排列的,请你判断下列三组物质是按什么规律排列的.
(1)NH3、N2、N2O、NO2、HNO3 排列规律是
(2)CH4、NH3、H2O、HF排列规律是
(3)CO(NH2)2、NH4NO3、NH4CI、(NH4)2SO4、NH4HCO3排列规律是
(1)NH3、N2、N2O、NO2、HNO3 排列规律是
按氮元素化合价由低到高排列
按氮元素化合价由低到高排列
.(2)CH4、NH3、H2O、HF排列规律是
按分子中原子个数由多到少排列
按分子中原子个数由多到少排列
.(3)CO(NH2)2、NH4NO3、NH4CI、(NH4)2SO4、NH4HCO3排列规律是
按氮元素的质量分数由高到低排列
按氮元素的质量分数由高到低排列
.分析:(1)根据化合物中的氮元素的化合价来分析排列规律;
(2)根据化合物分子中的原子个数来分析排列规律;
(3)根据化合物中氮元素的质量分数来分析排列规律.
(2)根据化合物分子中的原子个数来分析排列规律;
(3)根据化合物中氮元素的质量分数来分析排列规律.
解答:解:(1)因NH3中氮元素的化合价为-3价,N2,中氮元素的化合价为0,N2O中氮元素的化合价为+1价,NO2中氮元素的化合价为+4价,HNO3中氮元素的化合价为+5价,即该组物质是按照氮元素的化合价由低到高的顺序排列的,故答案为:按氮元素化合价由低到高排列;
(2)因CH4的1个分子中含有5个原子,NH3的1个分子中含有4个原子,H2O的1个分子中含有3个原子,HF的1个分子中含有2个原子,即该组物质是按照分子中的原子个数由多到少得顺序排列的,故答案为:按分子中原子个数由多到少排列;
(3)因CO(NH2)2中氮元素的质量分数为
×100%=46.7%,NH4NO3中氮元素的质量分数为
×100%=35%,NH4Cl中氮元素的质量分数为
×100%=26.2%,(NH4)2SO4中氮元素的质量分数为
×100%=21.2%,NH4HCO3中氮元素的质量分数为
×100%=17.7%,即该组物质是按照氮元素的质量分数由高到低排列的,故答案为:按氮元素的质量分数由高到低排列.
(2)因CH4的1个分子中含有5个原子,NH3的1个分子中含有4个原子,H2O的1个分子中含有3个原子,HF的1个分子中含有2个原子,即该组物质是按照分子中的原子个数由多到少得顺序排列的,故答案为:按分子中原子个数由多到少排列;
(3)因CO(NH2)2中氮元素的质量分数为
| 14×2 |
| 12+16+16×2 |
| 14×2 |
| 14×2+1×4+16×3 |
| 14 |
| 14+1×4+35.5 |
| 14×2 |
| 14×2+1×8+32+16×4 |
| 14 |
| 14+1×5+12+16×3 |
点评:本题考查了学生利用元素的化合价、分子中的原子个数、元素的质量分数来分析化合物的排列规律,熟悉化合价的计算及元素的质量分数计算是解答的关键.

练习册系列答案
相关题目