题目内容
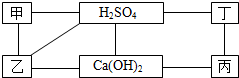
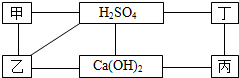
 图中每条直线两端的物质在一定条件下都可以发生化学反应.其中甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、盐酸四种物质中的一种.
图中每条直线两端的物质在一定条件下都可以发生化学反应.其中甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、盐酸四种物质中的一种.(1)写出甲和乙两种物质的化学式:甲
BaCl2
BaCl2
、乙Na2CO3
Na2CO3
;(2)写出下列物质发生反应的化学方程式:乙和Ca(OH)2:
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
;丙和丁:Mg+2HCl=MgCl2+H2↑
Mg+2HCl=MgCl2+H2↑
.分析:根据题给条件并结合氢氧化钙和稀硫酸的性质可知:能够和氢氧化钙反应的物质有碳酸钠和盐酸,那么乙和丙就分别是这两种物质,甲和丁就应该是镁和氯化钡,而乙能够和硫酸反应,从而我们判断乙应该是碳酸钠,丙为盐酸;同时甲也可以和乙反应,那么甲就应该为氯化钡,丁是镁,据此解答.
解答:解:(1)在给定的转化关系中,硫酸与甲、乙、丁三种物质反应,而甲、乙、丙、丁(Mg、BaCl2、Na2CO3、HCl)中只有HCl不和硫酸反应,所以丙为HCl;由氢氧化钙与乙反应,推出乙为Na2CO3,而甲与乙反应,甲为BaCl2,丁为Mg;
(2)在(1)中我们判断出乙为碳酸钠,在剩余的两种物质中能和稀硫酸反应的就是镁,所以丁为镁,丙就是盐酸,因此乙和Ca(OH)2的反应方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;丙和丁反应的方程式为:Mg+2HCl═MgCl2+H2↑.
故答案为:(1)BaCl2;Na2CO3; (2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;Mg+2HCl=MgCl2+H2↑.
(2)在(1)中我们判断出乙为碳酸钠,在剩余的两种物质中能和稀硫酸反应的就是镁,所以丁为镁,丙就是盐酸,因此乙和Ca(OH)2的反应方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;丙和丁反应的方程式为:Mg+2HCl═MgCl2+H2↑.
故答案为:(1)BaCl2;Na2CO3; (2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;Mg+2HCl=MgCl2+H2↑.
点评:本题属于框图式的推断题,关键是找到推断的突破口,依据物质的性质进行顺推或逆推得出相关物质的结论,然后带入验证即可.

练习册系列答案
相关题目