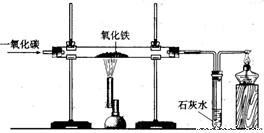
题目内容
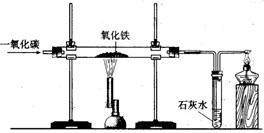 下图是课堂模拟炼铁的实验装置.小明按照下图进行实验:
下图是课堂模拟炼铁的实验装置.小明按照下图进行实验:(1)在硬质玻璃管中发生反应的化学方程式为:
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(2)装置中酒精灯的作用是
防止没反应的一氧化碳污染空气
防止没反应的一氧化碳污染空气
,(3)实验结束,小明观察到红色固体全部变黑了,为了进一步验证其固体成分.
小明查到下列资料:
Ⅰ一氧化碳还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质;
Ⅱ铁的各种氧化物中,氧化铁为红棕色,其余都为黑色,并且只有四氧化三铁能被磁铁吸引.
Ⅲ铁的氧化物都能与酸反应而溶解.
小明取用少量黑色粉末置于小烧杯中,加入适量的
硫酸铜
硫酸铜
试剂,经过实验观察到黑色固体全部消失,有红色固体生成
黑色固体全部消失,有红色固体生成
现象,说明氧化铁全部被还原为铁单质.(4)小明重新取用生成的黑色粉末5.6g,加入至146.6g一定质量分数的稀硫酸中,充分反应后,固体完全消失.请问,反应最多能产生气体多少克?完全反应后,生成物质的溶质质量分数为多少?(请严格按照计算题格式完成.)
分析:(1)根据方程式的写法考虑本题;
(2)根据反应后没参加反应的一氧化碳能污染空气考虑;
(3)根据铁和铁的氧化物区别考虑,铁和铁的氧化物都能与酸反应,但铁的氧化物不能与盐反应,铁却能与盐反应;
(4)根据铁的质量算出氢气的质量,根据铁的质量算出硫酸亚铁的质量,再用硫酸亚铁的质量除以反应后溶液质量即可.
(2)根据反应后没参加反应的一氧化碳能污染空气考虑;
(3)根据铁和铁的氧化物区别考虑,铁和铁的氧化物都能与酸反应,但铁的氧化物不能与盐反应,铁却能与盐反应;
(4)根据铁的质量算出氢气的质量,根据铁的质量算出硫酸亚铁的质量,再用硫酸亚铁的质量除以反应后溶液质量即可.
解答:解:(1)写方程式的步骤是一写二配三注明四等号:反应物是一氧化碳和氧化铁,生成物是铁和二氧化碳,反应条件是高温,用观察法配平;
(2)用酒精灯将没参加反应的一氧化碳转化为二氧化碳,因为一氧化碳有毒能污染空气;
(3)铁和铁的氧化物都能与酸反应,但铁的氧化物不能与盐反应,铁却能与盐反应,所以加入硫酸铜,只有铁与硫酸铜反应且生成红色的铜,如果反应结束黑色固体全部消失,说明生成物中全是铁;
(4)设5.6g铁完全反应生成氢气质量为X,生成硫酸亚铁质量为Y则:
Fe+H2SO4═FeSO4+H2↑
56 152 2
5.6g Y X
根据:
=
解得X=0.2g,根据:
=
解得Y=15.2g,反应后溶液的质量为:5.6g+146.6g-0.2g=152g,所以完全反应后,生成物质的溶质质量分数为
×100%=10%.
故答案为:
(1)3CO+Fe2O3
2Fe+3CO2;
(2)防止没反应的一氧化碳污染空气;
(3)硫酸铜;黑色固体全部消失,有红色固体生成;
(4)0.2g;10%.
(2)用酒精灯将没参加反应的一氧化碳转化为二氧化碳,因为一氧化碳有毒能污染空气;
(3)铁和铁的氧化物都能与酸反应,但铁的氧化物不能与盐反应,铁却能与盐反应,所以加入硫酸铜,只有铁与硫酸铜反应且生成红色的铜,如果反应结束黑色固体全部消失,说明生成物中全是铁;
(4)设5.6g铁完全反应生成氢气质量为X,生成硫酸亚铁质量为Y则:
Fe+H2SO4═FeSO4+H2↑
56 152 2
5.6g Y X
根据:
| 56 |
| 2 |
| 5.6g |
| X |
| 56 |
| 152 |
| 5.6g |
| Y |
| 15.2g |
| 152g |
故答案为:
(1)3CO+Fe2O3
| ||
(2)防止没反应的一氧化碳污染空气;
(3)硫酸铜;黑色固体全部消失,有红色固体生成;
(4)0.2g;10%.
点评:通过回答本题知道了炼铁的反应原理,尾气处理方法,鉴别生成物的方法,进一步熟悉了利用方程式进行计算的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
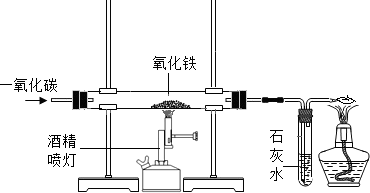
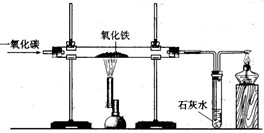 下图是课堂模拟炼铁的实验装置.小明按照下图进行实验:
下图是课堂模拟炼铁的实验装置.小明按照下图进行实验: