题目内容
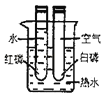
【题目】图1是实验室制取气体的常见装置,请据图回答有关问题

(1)写出序号为①、②的仪器名称:①______;②______;
(2)实验室常选用A装置,用一种白色固体与一种黑色粉末混合加热以制备氧气,请写出该反应的化学方程式______;
①根据O2的密度特点,可选用的收集装置是______;
②若选排水法收集,实验结束后应______;(填字母)
A.先熄灭酒精灯,再从水槽中取出导管 B.先从水槽中取出导管,再熄灭酒精灯
(3)实验室制取二氧化碳的方程式为______;
①若选用图2装置收集CO2,则气体从______端通入(填“a”或“b”),如何验满______;
②若用该装置检验CO2,瓶中需装入的药品是______,气体从______端通入(填“a”或“b”),如果含有CO2,则发生反应的方程式为______。
(4)实验室用块状电石与水在常温下反应制取乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂你认为图1中最适合制取乙炔气体的发生装置是______;乙炔在空气中燃烧产生的火焰称为“氧炔焰”,可用来切割和焊接金属。故为了防止乙炔气体在点燃时发爆炸,点燃前一定要进行______操作。
【答案】锥形瓶; 长颈漏斗 2KClO3![]() 2KCl+3O2↑ D B CaCO3+2HCl=CaCl2+H2O+CO2↑ a 将一根燃着的木条放在导管b端处,观察到木条熄灭,证明二氧化碳已满 澄清的石灰水 a CO2+Ca(OH)2=CaCO3↓+H2O B 验纯
2KCl+3O2↑ D B CaCO3+2HCl=CaCl2+H2O+CO2↑ a 将一根燃着的木条放在导管b端处,观察到木条熄灭,证明二氧化碳已满 澄清的石灰水 a CO2+Ca(OH)2=CaCO3↓+H2O B 验纯
【解析】
(1)据图可知仪器①是锥形瓶;②是长颈漏斗;
(2)装置A适用于固体加热制取气体,氯酸钾是一种白色固体,二氧化锰是一种黑色固体,氯酸钾在二氧化锰的催化作用下、加热分解为氯化钾和氧气;反应的化学方程式:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
①氧气的密度比空气大,可用向上排空气法来收集氧气;
②为了防止冷水倒吸、炸裂试管,若选排水法收集,实验结束后应将导管移出水面,再熄灭酒精灯;
(3)在实验室中常用大理石或石灰石与稀盐酸反应来制取二氧化碳,大理石和石灰石的主要成分是碳酸钙,碳酸钙与盐酸反应生成了氯化钙、水和二氧化碳;反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;
①二氧化碳的密度比空气大,若用图2装置收集二氧化碳时,二氧化碳应从长管进入;二氧化碳不燃烧、也不支持燃烧,验满时将一根燃着的木条放在导管b端处,观察到木条熄灭,证明二氧化碳已满;
②二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,反应的化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O;所以可用澄清的石灰水来检验二氧化碳气体,气体从长管进入;
(4)实验室用块状电石与水反应制取微溶于水的乙炔气体不需要加热,应该用B或C装置作为发生装置,B装置中能控制加水的速率,从而可以控制反应速率,而A装置不能够控制加水的速率,无法控制反应速率,因此最适合制取乙炔气体的发生装置是B装置;若可燃性气体不纯,点燃有可能发生爆炸,所以点燃可燃性气体前一定要检验其纯度。

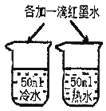
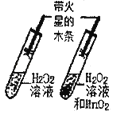
【题目】对比实验是实验探究的重要方法,下列对比实验设计不能实现相应实验目的是( )
实验设计 |
|
|
|
|
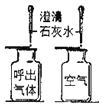
选项 | A探究温度对分子运动快慢的影响 | B探究MnO2能否加H2O2分解 | C.探究空气是燃烧的必要条件 | D.探究空气、呼出气体中CO2含量 |
A. A B. B C. C D. D