��Ŀ����
����Ŀ��������һ����������ɫ����ˮռ��ȫ��ˮ��Դ��97%����ˮ��Դ�Ŀ��������þ��зdz�������ǰ����
��1����ˮ�к��д�����NaCl���������Ʊ��Ƽ��仯�����������ͼ��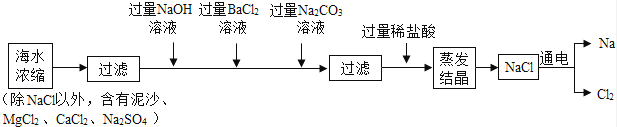
�ټ������Na2CO3��ҺĿ���dz�ȥCaCl2�� �� �����в����ù���ϡ����������ϡ�����ԭ������
���ᴿ������ʹ���˹��˺�����������ʵ���ҹ��˺�����������ʹ�õ��IJ�����������
������ͼ���Ʊ������ƵĻ�ѧ����ʽΪ ��
��2����ҵ�����õ�ⱥ��ʳ��ˮ�ķ����Ʊ�NaOH����ͬʱ������ֵ��ʣ����䲢��ƽ��ѧ����ʽ��
NaCl+ H2O![]() NaOH��+ H2����+ Cl2�� ��
NaOH��+ H2����+ Cl2�� ��
��3����͢��ʵ�����ҵ�һƿ���ڷ��õ�NaOH��Һ��������ɷֽ���ʵ��̽����
���������ϡ�
I��NaOH��CO2��������Ӧ��
2NaOH+CO2�TNa2CO3+H2O��Na2CO3+CO2+H2O�T2NaHCO3
��NaOH��NaHCO3��Ӧ����ʽΪ��NaOH+NaHCO3�TNa2CO3+H2O
�����ʵ��ܽ��ԣ�
CO32�� | HCO3�� | OH�� | |
Ba2+ | ���� | �� | �� |
��Һ������ԣ�BaCl2��Һ�����ԣ�
��������롿��͢���������е�I�������ɷ������5�ֺ������룬�뽫���벹��������
����1��ֻ��NaOH������2�� �� ����3��ֻ��Na2CO3 �� ����4�� ��
����5��ֻ��NaHCO3 ��
��ʵ����֤��
���� | ���� | ���� | ���� |
����1 | ȡ��NaOH��Һ���������BaCl2��Һ | ������ɫ���� | ֤������ �������������֣� |
����2 | ȡ����1���ϲ���Һ���μ� | �����ݲ��� | ֤��ԭ��Һ���� ������ӡ��� |
����3 | ��ȡ����1���ϲ���Һ���μ� | ��Һδ��� | ֤��ԭ��Һ���� ������ӡ��� |
��ʵ����ۡ�
ͨ������ʵ������ó����ۣ����� ����ȷ�ģ������֣���
���𰸡�
��1���Ȼ������������µ����������ƣ���������2NaCl![]() 2Na+Cl2��
2Na+Cl2��
��2��2��2��2��1��1
��3�������������ơ�̼���ƣ�̼�����ơ�̼���ƣ�1��5��ϡ���![]() ��
��![]() ����̪��OH����3
����̪��OH����3
����������1����̼������Ӻ����ӡ������ӻ�����̼��Ƴ�����̼�ᱵ���������Լ������Na2CO3��ҺĿ���dz�ȥCaCl2���Ȼ�����������������ơ�̼���ƻ����������ƣ����Բ����ù���ϡ����������ϡ�����ԭ���ǻ������µ����������ƣ�
�������������õ��IJ��������в��������ƾ��ƣ����˹������õ��IJ����������ձ���©����������������������������Ҫ�IJ��������в�������
���Ȼ�����ͨ��������������ƺ���������ѧ����ʽΪ��2NaCl![]() 2Na+Cl2����
2Na+Cl2����
��2���Ȼ�����Һ��ͨ��������������������ơ�������������Ȼ�����������غ㶨�ɽ�����ƽ����ѧ����ʽΪ��2NaCl+2H2O![]() 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
��3����������롿������̼���������Ƶķ�ӦΪ��2NaOH+CO2�TNa2CO3+H2O��Na2CO3+CO2+H2O�T2NaHCO3��
NaOH+NaHCO3�TNa2CO3+H2O�����Բ���2�������������ơ�̼���ƣ�����4��̼�����ơ�̼���ƣ�
��ʵ����֤��̼������Ӻͱ����ӻ�����̼�ᱵ����������̼������ӡ�̼��������Ӻ��ᷴӦ���ɶ�����̼���壬������������ʹ��̪���ɫ������
���� | ���� | ���� | ���� |
����1 | ȡ��NaOH��Һ���������BaCl2��Һ | ������ɫ���� | ֤������1��5�������������֣� |
����2 | ȡ����1���ϲ���Һ���μ�ϡ���� | �����ݲ��� | ֤��ԭ��Һ���� |
����3 | ��ȡ����1���ϲ���Һ���μӷ�̪ | ��Һδ��� | ֤��ԭ��Һ����OH��������ӡ��� |
��ʵ����ۡ�ͨ��ǰ��ķ�����֪������в����������ơ�̼�����ƣ�����̼���ƣ����Բ���3��ȷ��
���Դ��ǣ���1�����Ȼ������������µ����������ƣ��ڲ���������2NaCl![]() 2Na+Cl2������2��2NaCl+2H2O
2Na+Cl2������2��2NaCl+2H2O![]() 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
��3����������롿�����������ơ�̼���ƣ�̼�����ơ�̼���ƣ�
��ʵ����֤��
���� | ���� | ���� | ���� |
����1 | 1��5 | ||
����2 | ϡ���� |
| |
����3 | ��̪ | OH�� |
��ʵ����ۡ�3��
�����㾫����������Ĺؼ�����������˲�����ע����������֪ʶ�����չ��˲���ע�������һ���������͡������������˺���Һ��Ȼ���ǵĿ���ԭ����:�ٳн���Һ���ձ����ɾ����㵹Һ��ʱҺ�������ֽ��Ե����ֽ�����Լ�����д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����⣬�˽�ע�⣺a����ƽ b������ c�����ţ�
