题目内容
请结合下列实验常用装置,回答有关问题。
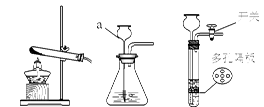
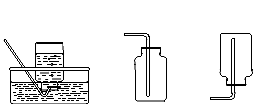
A B C D E F
(1)写出仪器a的名称: 。
(2)若用氯酸钾和二氧化锰制取氧气,该反应的化学方程式是 ,二氧化锰在此反应中的作用是 。将装置A和D连接进行此实验,实验结束,停止加热前要先将导管移出水面,目的是 。
(3)若用块状石灰石和稀盐酸制取二氧化碳,选用的装置组合是 (填字母编号),在加试剂之前的操作是 。将收集到的二氧化碳气体通入盛有蒸馏水的试管,一段时间后,测得该试管中溶液的pH (填“>”、“<”或“=”)7,对该现象的合理解释为 (用化学方程式表示)。
(4)C O2
O2 CO2是我们最熟悉的反应,为什么在实验室我们不利用碳的燃烧来制取CO2,其主要原因是 (写出 1条)。
CO2是我们最熟悉的反应,为什么在实验室我们不利用碳的燃烧来制取CO2,其主要原因是 (写出 1条)。
(5)某同学用石灰石和稀盐酸完成“制取并检验CO2”的实验,消耗了73克10%的盐酸。计算实验过程中产生CO2的物质的量是多少?


A B C D E F
(1)写出仪器a的名称: 。
(2)若用氯酸钾和二氧化锰制取氧气,该反应的化学方程式是 ,二氧化锰在此反应中的作用是 。将装置A和D连接进行此实验,实验结束,停止加热前要先将导管移出水面,目的是 。
(3)若用块状石灰石和稀盐酸制取二氧化碳,选用的装置组合是 (填字母编号),在加试剂之前的操作是 。将收集到的二氧化碳气体通入盛有蒸馏水的试管,一段时间后,测得该试管中溶液的pH (填“>”、“<”或“=”)7,对该现象的合理解释为 (用化学方程式表示)。
(4)C
 O2
O2 CO2是我们最熟悉的反应,为什么在实验室我们不利用碳的燃烧来制取CO2,其主要原因是 (写出 1条)。
CO2是我们最熟悉的反应,为什么在实验室我们不利用碳的燃烧来制取CO2,其主要原因是 (写出 1条)。(5)某同学用石灰石和稀盐酸完成“制取并检验CO2”的实验,消耗了73克10%的盐酸。计算实验过程中产生CO2的物质的量是多少?
(1)长颈漏斗
(2)2KClO3 2KCl+3O2↑ 催化作用(或加快反应速度) 防止水倒流造成试管破裂
2KCl+3O2↑ 催化作用(或加快反应速度) 防止水倒流造成试管破裂
(3)B E或CE(答一组不扣分) 检查装置气密性 < CO2+H2O ="=" H2CO3
(4)反应物中有气体参加,很难收集到纯净的二氧化碳(或燃烧条件下,很难将其控制在一个密闭的环境中进行,所以无法收集等)(其他合理也可)
(5)0.1mol。
(2)2KClO3
 2KCl+3O2↑ 催化作用(或加快反应速度) 防止水倒流造成试管破裂
2KCl+3O2↑ 催化作用(或加快反应速度) 防止水倒流造成试管破裂(3)B E或CE(答一组不扣分) 检查装置气密性 < CO2+H2O ="=" H2CO3
(4)反应物中有气体参加,很难收集到纯净的二氧化碳(或燃烧条件下,很难将其控制在一个密闭的环境中进行,所以无法收集等)(其他合理也可)
(5)0.1mol。
试题分析:(1)根据仪器的形状和用途书写仪器的名称;(2)在氯酸钾的分解反应中,氯酸钾是反应物,二氧化锰是这个反应的催化剂,生成物是氯化钾和氧气,根据以上信息书写化学方程式;为了防止水倒流造成试管破裂,所以在实验结束,停止加热前要先将导管移出水面;(3)根据反应物状态和反应条件确定发生装置;为了顺利的收集纯净的气体,在制取气体之前一定要先检查装置的气密性;由于二氧化碳与水反应生成的碳酸显酸性,所以二氧化碳气体通入盛有蒸馏水的试管,一段时间后,测得该试管中溶液的pH小于7;(4)由于反应物中有气体参加,很难收集到纯净的二氧化碳,所以在实验室不利用碳的燃烧来制取CO2;要计算生成的二氧化碳的物质的量,首先要计算出参加反应的氯化氢的物质的量,然后根据碳酸钙和稀盐酸反应的化学方程式及稀盐酸的物质的量计算出反应生成的二氧化碳的物质的量。
解:73g10%的盐酸中溶质为7.3g,物质的量为0.2mol (1分)
设实验过程中产生CO2的物质的量为xmol
CaCO3+2HCl
 CaCl2+H2O+CO2↑ (1分)
CaCl2+H2O+CO2↑ (1分) 2mol 1mol
0.2mol x
2:0.2= 1:x (1分)
解得x="0." 1mol (1分)
答:实验过程中产生CO2的物质的质为0.1mol

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目




