题目内容
现有氧化铜和铜的混合物,对其成分进行分析.取10g此样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:(反应的化学方程式:CuO+H2SO4═CuSO4+H2O)| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 充分反应后剩余固体质量/g | 8 | 6 | 4 | 3 | m |
(1)上述表格中m的值为______.
(2)计算所加入稀硫酸中溶质的质量分数?
(3)计算第三次加稀硫酸反应后所得溶液中溶质的质量分数______(精确到0.1%)
【答案】分析:(1)根据实验数据分析出加入的稀硫酸与参加反应的氧化铜的质量比关系,进而可确定m的值;固体前后减少的质量为氧化铜的质量.
(2)根据实验数据可知20克稀硫酸与2克氧化铜恰好完全反应,利用氧化铜与硫酸反应的化学方程式,根据2克氧化铜的质量求出20克稀硫酸中溶质的质量,最后根据 ×100%求出稀硫酸中溶质的质量分数.
×100%求出稀硫酸中溶质的质量分数.
(3)第三次反应后60克稀硫酸与6克氧化铜恰好完全反应,所得溶液中溶质的质量分数=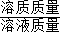 ×100%.溶质为硫酸铜,根据6克氧化铜的质量可求出,所得溶液的质量=参加反应的氧化铜的质量+所加稀硫酸的质量.
×100%.溶质为硫酸铜,根据6克氧化铜的质量可求出,所得溶液的质量=参加反应的氧化铜的质量+所加稀硫酸的质量.
解答:解:(1)根据实验数据分析可知,每20克稀硫酸与2克氧化铜恰好完全反应,第四次加入20克稀硫酸后只反应了1克氧化铜,说明氧化铜已反应完,第五次再加入稀硫酸,剩余固体的质量也不会减少.所以m的值为3.故答案为:3;
(2)设20克稀硫酸中溶质的质量为x
CuO+H2SO4═CuSO4+H2O
80 98
2g x
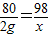
x=2.45g
H2SO4溶液中溶质质量分数=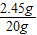 ×100%=12.25%
×100%=12.25%
(3)设第三次加稀硫酸反应后所得溶液中溶质的质量为y
CuO+H2SO4═CuSO4+H2O
80 160
6g y
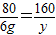
y=12g
第三次加稀硫酸反应后所得溶液中溶质质量分数=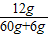 ×100%=18.2%
×100%=18.2%
答:(2)所加入稀硫酸中溶质质量分数为12.25%;
(3)第三次加稀硫酸反应后所得溶液中溶质质量分数为18.2%.
点评:解答本题可用数据分析法,即解题时正确分析数据,找出数据的变化特征及彼此之间的关系,将综合复杂的问题分解为简单的计算,从而顺利解题.
(2)根据实验数据可知20克稀硫酸与2克氧化铜恰好完全反应,利用氧化铜与硫酸反应的化学方程式,根据2克氧化铜的质量求出20克稀硫酸中溶质的质量,最后根据
 ×100%求出稀硫酸中溶质的质量分数.
×100%求出稀硫酸中溶质的质量分数.(3)第三次反应后60克稀硫酸与6克氧化铜恰好完全反应,所得溶液中溶质的质量分数=
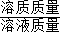 ×100%.溶质为硫酸铜,根据6克氧化铜的质量可求出,所得溶液的质量=参加反应的氧化铜的质量+所加稀硫酸的质量.
×100%.溶质为硫酸铜,根据6克氧化铜的质量可求出,所得溶液的质量=参加反应的氧化铜的质量+所加稀硫酸的质量.解答:解:(1)根据实验数据分析可知,每20克稀硫酸与2克氧化铜恰好完全反应,第四次加入20克稀硫酸后只反应了1克氧化铜,说明氧化铜已反应完,第五次再加入稀硫酸,剩余固体的质量也不会减少.所以m的值为3.故答案为:3;
(2)设20克稀硫酸中溶质的质量为x
CuO+H2SO4═CuSO4+H2O
80 98
2g x
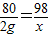
x=2.45g
H2SO4溶液中溶质质量分数=
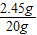 ×100%=12.25%
×100%=12.25%(3)设第三次加稀硫酸反应后所得溶液中溶质的质量为y
CuO+H2SO4═CuSO4+H2O
80 160
6g y
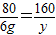
y=12g
第三次加稀硫酸反应后所得溶液中溶质质量分数=
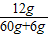 ×100%=18.2%
×100%=18.2%答:(2)所加入稀硫酸中溶质质量分数为12.25%;
(3)第三次加稀硫酸反应后所得溶液中溶质质量分数为18.2%.
点评:解答本题可用数据分析法,即解题时正确分析数据,找出数据的变化特征及彼此之间的关系,将综合复杂的问题分解为简单的计算,从而顺利解题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
| |||||||||||||||