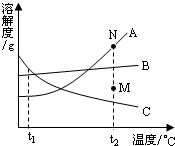
题目内容
A、B、C三种物质的溶解度随温度的变化情况如图:(1)______温度时,A、B物质的溶解度相等
(2)t1时它们的溶解度大小顺序是______
(3)t1时,将50g的A物质溶于100g水中,所得溶液为______g.
(4)t1时,ABC分别与水配制成饱和溶液,其溶质的质量分数相对最大的物质是______.
(5)t1时,将C的接近饱和的溶液,变成饱和,可采取的方法有:______;______;______.
(6)若从B的溶液中提取B固体,一般用______的方法.
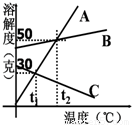
【答案】分析:(1)根据曲线中交点的含义考虑;
(2)根据某一温度时物质溶解度的比较方法考虑;
(3)关键要根据该温度时的溶解度看所加物质是否全部溶解;
(4)根据饱和溶液的质量分数的计算方法考虑;
(5)根据不饱和溶液与饱和溶液的转化方法考虑;
(6)根据固体物质从溶液中结晶析出的方法考虑.
解答:解:
(1)曲线中交点表示该温度时两种物质的溶解度相等,所以t2温度时,A、B物质的溶解度相等;
(2)从t1向上做垂线,与曲线的交点在上面的溶解度就大,所以t1时它们的溶解度大小顺序是B>A=C;
(3)t1时,A的溶解度为30g,也就是说100g水中最多溶解30gA物质,所以加入50g只能溶解30g,溶液质量为130g;
(4)饱和溶液的质量分数可以用该公式计算: ×100%,所以饱和溶液的质量分数取决于溶解度的大小,t1溶解度最大的是B,所以饱和溶液溶质质量分数最大的也是B;
×100%,所以饱和溶液的质量分数取决于溶解度的大小,t1溶解度最大的是B,所以饱和溶液溶质质量分数最大的也是B;
(5)接近饱和的溶液,变成饱和可以用加入溶质和蒸发溶剂,因为C的溶解度随温度的升高而减小,所以也可以通过升高温度实现;
(6)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.
故答案为:
(1)t2
(2)B>A=C
(3)130克
(4)B
(5)蒸发溶剂,加溶质,升高温度
(6)蒸发溶剂
点评:通过回答本题知道了溶解度曲线表示的意义,知道了溶解度如何比较大小,饱和溶液溶质质量分数的计算公式,饱和溶液与不饱和溶液的相互转化,固体物质从溶液中结晶析出的方法.
(2)根据某一温度时物质溶解度的比较方法考虑;
(3)关键要根据该温度时的溶解度看所加物质是否全部溶解;
(4)根据饱和溶液的质量分数的计算方法考虑;
(5)根据不饱和溶液与饱和溶液的转化方法考虑;
(6)根据固体物质从溶液中结晶析出的方法考虑.
解答:解:
(1)曲线中交点表示该温度时两种物质的溶解度相等,所以t2温度时,A、B物质的溶解度相等;
(2)从t1向上做垂线,与曲线的交点在上面的溶解度就大,所以t1时它们的溶解度大小顺序是B>A=C;
(3)t1时,A的溶解度为30g,也就是说100g水中最多溶解30gA物质,所以加入50g只能溶解30g,溶液质量为130g;
(4)饱和溶液的质量分数可以用该公式计算:
 ×100%,所以饱和溶液的质量分数取决于溶解度的大小,t1溶解度最大的是B,所以饱和溶液溶质质量分数最大的也是B;
×100%,所以饱和溶液的质量分数取决于溶解度的大小,t1溶解度最大的是B,所以饱和溶液溶质质量分数最大的也是B;(5)接近饱和的溶液,变成饱和可以用加入溶质和蒸发溶剂,因为C的溶解度随温度的升高而减小,所以也可以通过升高温度实现;
(6)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.
故答案为:
(1)t2
(2)B>A=C
(3)130克
(4)B
(5)蒸发溶剂,加溶质,升高温度
(6)蒸发溶剂
点评:通过回答本题知道了溶解度曲线表示的意义,知道了溶解度如何比较大小,饱和溶液溶质质量分数的计算公式,饱和溶液与不饱和溶液的相互转化,固体物质从溶液中结晶析出的方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 6、下图为A、B、C三种物质的溶解度曲线,试回答下列问题:
6、下图为A、B、C三种物质的溶解度曲线,试回答下列问题: (2013?广东模拟)“
(2013?广东模拟)“ ”、“
”、“ ”、“
”、“ ”分别表示A、B、C三种物质的原子,下列关于如图说法正确的是( )
”分别表示A、B、C三种物质的原子,下列关于如图说法正确的是( )
 (2012?吴中区三模)如图是a、b、c三种物质的溶解度曲线,回答下列问题:
(2012?吴中区三模)如图是a、b、c三种物质的溶解度曲线,回答下列问题: