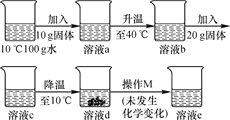
题目内容
【题目】钠摄入过量或钾摄入不足都是导致高血压的风险因素.日常生活中选择食用低钠盐能实现减钠补钾.如图为某品牌低钠盐的标签,请你根据标签回答以下问题:
(1)溶剂水中氢元素与氧元素的质量为______.(最简整数比)
(2)人体每天摄入钠元素的质量不宜超过2.3g.如果人体所需的钠元素全部来自该品牌食盐,那么一个人每天摄入该品牌低钠盐的质量不宜超过_______克?(写出计算过程,结果保留一位小数)

【答案】 1:8 8.4g
【解析】(1)由水的化学式为H2O可知,氢元素与氧元素的质量比=(1×2):16= 1:8 ;(2) 设一个人每天摄入该品牌低钠盐不宜超过的质量为x,x×70%×![]() =2.3g,x=8.4g,
=2.3g,x=8.4g,
答:一个人每天摄入该品牌低钠盐的质量不宜超过8.4g。

【题目】小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
(实验探究)稀盐酸与氢氧化钠反应的化学方程式为_____。
(提出猜想)所得溶液可能呈碱性,也可能呈_____性,还可能呈_____性。
(实验验证)
实验操作 | 实验现象 | 结论 |
用试管取该溶液1﹣2mL,滴入 1﹣2滴无色酚酞试液,振荡 | 无色酚酞试液变_____ | 溶液呈碱性 |
无色酚酞试液不变色 | 溶液呈_____ |
若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
取样,加入金属锌,若有所泡产生,则所取溶液呈酸性,该反应的化学方程式为_____;若无明显现象,则溶液呈_____性。
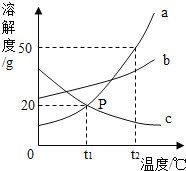
(分析论证)如图是小亮同学根据实验绘制的溶液的pH随加入溶液的质量变化的曲线。
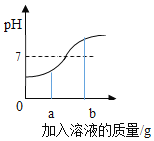
①氢氧化钠与盐酸恰好完完全反应时,溶液的pH_____7(填“>“<”或“=”)
②根据曲线判断,小亮是将_____(填“氢氧化钠溶液”或“盐酸”,下同)滴入_____中。
③当滴入溶液的质量为bg时,向所得溶液中滴加酚酞溶液,溶液颜色为_____色,此时溶液中的溶质是_____、_____。