题目内容
【题目】氢气可以由甲醇(CH3OH)转化获得,甲醇转化为氢气的流程如下:
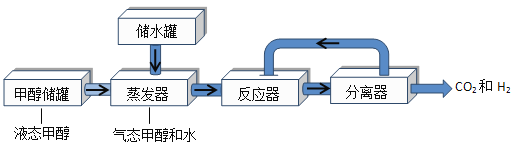
(1)甲醇(CH3OH)中碳、氢元素质量比_______;甲醇中氧元素的质量分数________。
(2)在反应器内发生两个反应:① ②
② 。则反应①的基本类型为________反应;
。则反应①的基本类型为________反应;
(3)氢气还可以通过煤的气化得到,其主要反应的微观示意图如下:
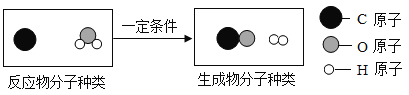
该反应的化学方程式是___________。
(4)人们正在开发和利用新能源,除了氢能源外,还有(任举一种)_______。
【答案】3:1 50% 分解 C+H2O CO+H2 太阳能(或核能,或风能,或地热能,或潮汐能等)
CO+H2 太阳能(或核能,或风能,或地热能,或潮汐能等)
【解析】
(1)甲醇(CH3OH)碳、氢元素质量比为12:(1×4)=3:1;甲醇中氧元素的质量分数=![]() ;
;
(2)根据化学方程式① ,此反应符合一变多的特征,属于分解反应;
,此反应符合一变多的特征,属于分解反应;
(3)碳和水蒸气在一定条件生成氢气和一氧化碳,化学方程式为:C+H2O CO+H2;
CO+H2;
(4)新能源是具有再生性,无污染的能源:太阳能(或核能,或风能,或地热能,或潮汐能等)。

【题目】同学们在学习了氧气的制取和性质后,对课后习题中所提供的仪器、药品产生了浓厚的兴趣,利用它们及其他必要物品进行实验并展开探究。
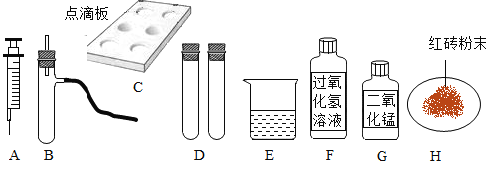
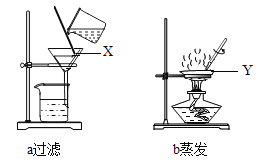
(1)小丽选择了上述仪器中的__________(填字母序号,下同)组装了制取氧气的发生装置,反应的文字表达式为__________。为了收集到纯净的氧气,她选择的仪器是_____________。
(2)同学们又对提供的红砖粉末进行探究。
[提出问题]红砖粉末能否作为过氧化氢溶液分解的催化剂?它是否比二氧化锰的催化效果更好?
[实验探究]
实验步骤 | 实验操作及现象 | 实验结论 |
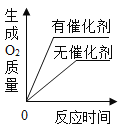
步骤一 | 取5 mL过氧化氢溶液于试管中,将带火星的木条伸入试管中,木条没有复燃;向上述试管中加人少量红砖粉末,将带火星木条伸入试管中,木条复燃。 | _____________。 |
步骤二 | 在步骤一的试管中再次加人过氧化氢溶液,将带火星木条伸入试管中,木条复燃,待试管中又没有现象发生时,再多次重复上述操作,看到带火星木条依然能复燃。 | 依据是_____________。 |
步骤三 | 另取两支试管,各加入5mL过氧化氢溶液,再向试管中分别加入少量二氧化锰粉末和红砖粉末,观察到加入二氧化锰的试管产生气泡的速率明显大于加入红砖粉末的试管。 | _____________。 |
[反思评价]小红对步骤三的结论提出质疑,理由是_____________。
[拓展提升]小军使用另外一种仪器也完成了步骤三的实验,并且得出了同样的结论,他选择的是图中提供的仪器_____________(填字母序号),使用该仪器的优点是_____________(答一点即可),具体的操作是_____________。