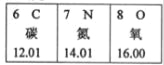
题目内容
【题目】某综合实践活动小组同学,对某化工厂排放的污水进行检测,发现主要的污染物为氢氧化钠.为测定污水中氢氧化钠的含量,取100g污水于烧杯中,加入36.5g质量分数为10%的稀盐酸恰好完全反应.(假设污水中其他成分不与稀盐酸反应)(反应的化学方程式为:NaOH + HCl ═ NaCl + H2O).求:
(1)100g污水中含氢氧化钠多少克?
(2)污水中所含氢氧化钠的质量分数.
【答案】100g污水中含Na0H的质量为4g,污水中NaOH的质量分数为4%.
【解析】(1)设100g污水中含氢氧化钠的质量为х.
NaOH+HCl═NaCl+H2O
40 36.5
х 36.5g×10%
40:36.5=х:(36.5g×10%),则x=4g
(2)污水中氢氧化钠的质量分数=![]() ×100%=4%
×100%=4%
答:100g污水中含Na0H的质量为4g,污水中NaOH的质量分数为4%.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】小强同学对样品中碳酸钙的质量分数进行检测,采用的办法如下:取用8g这种石灰石样品,把40g稀盐酸分4次加入,测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应).请计算:
(1)8g石灰石样品中含有杂质多少克?(2)样品中碳酸钙的质量分数是多少?
(3)下表中m的数值应该为多少?
序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
第1次 | 10 | 5 |
第2次 | 10 | m |
第3次 | 10 | 1.2 |
第4次 | 10 | 1.2 |
(4)要得到280kg CaO,需要质量分数为80%的石灰石多少千克?
(化学方程式:CaCO3![]() CaO+CO2↑)
CaO+CO2↑)