题目内容
【题目】某兴趣小组需要配制100g质量分数为9.8%的稀硫酸,假设常温下该稀硫酸的PH值为0.在装有100g该稀硫酸的烧杯中加入104.4gNa2CO3溶液,恰好完全反应,溶液呈中性.
(1)硫酸(H2SO4)的相对分子质量为 ;
(2)硫酸(H2SO4)中氧原子、氢原子的原子个数比为 ;
(3)实验室只有98%的浓硫酸,密度为1.84g/cm3.需要量取 mL(保留一位小数)
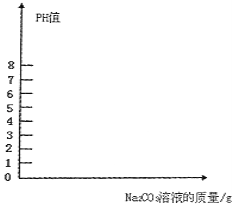
(4)如果向烧杯中滴加的碳酸钠溶液质量约为150g,在下图中,画出烧杯内溶液的PH值变化图象(标出Na2CO3溶液的质量)
![]()
![]()
![]()
![]()
(5)计算所得溶液的溶质质量分数是多少?(写出计算过程)
【答案】(1)98;(2)2:1;(3)5.4 (4)略 (5)7.1%
【解析】
试题分析:(1)硫酸的相对分子质量为:1×2+32+16×4=98;
(2)硫酸(H2SO4)中氧原子、氢原子的原子个数比为元素符号右下角的角标之比为2:1;
(3)根据溶液稀释前后溶质的质量不变,设需要浓硫酸的质量为X;100g×9.8g=98%×X;得到X=10g 需要量取的体积为:10g/1.84g/cm3=5.4ml
(4)
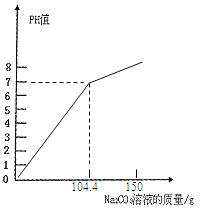
只要画出104.4克时PH=7,继续加碳酸钠PH>7,曲线向上即可。
(5)加入104.4克碳酸溶液完全反应后,溶液显中性,所得溶液是硫酸钠溶液,设反应生成Na2SO4质量为X,反应生成CO2质量为Y
H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
98 142 44
9.8g X Y
X= ( 142 ×9.8g)/98=14.2g Y=(44×9.8g)/98 =4.4
所得溶液的质量分数是:(100+104.4-4.4) /14.2×100%=7.1%
答:所得溶液的质量分数为7.1%(其它方法、结果都正确给分)

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案