题目内容
镁在空气中燃烧生成氧化镁,下列说法符合质量守恒定律的是( )
| A、4g镁与1gO2完全反应生成5gMgO | B、3g镁与2gO2完全反应生成5gMgO | C、8g镁与1gO2完全反应生成9gMgO | D、2g镁与10gO2完全反应生成12gMgO |
分析:根据题干信息可知,镁完全燃烧时,生成氧化镁.由它们反应的化学方程式各种物质的比例关系应用于质量守恒定律判断选项正误.
解答:解:由化学方程式2Mg+O2
2MgO能够可知:每有48份质量的镁和32份质量的氧气在点燃的条件下完全化合生成80份质量的氧化镁.即参加反应的镁、氧气和生成的氧化镁质量之比=3:2:5
A、不符合各比例关系,故错误;
B、符合质量守恒定律;故正确
C、不符合各比例关系,故错误;
D、不符合各比例关系,故错误;
故选B.
| ||
A、不符合各比例关系,故错误;
B、符合质量守恒定律;故正确
C、不符合各比例关系,故错误;
D、不符合各比例关系,故错误;
故选B.
点评:化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和即质量守恒定律.在这里要注意“参加反应”这四个字的含义.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
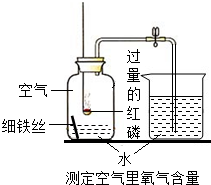 学习了空气中氧气的含量测定后,化学兴趣小组的同学对过量的红磷能否消耗完瓶中的氧气表示有疑问.请你参与他们的探究活动,并回答下列的问题:
学习了空气中氧气的含量测定后,化学兴趣小组的同学对过量的红磷能否消耗完瓶中的氧气表示有疑问.请你参与他们的探究活动,并回答下列的问题: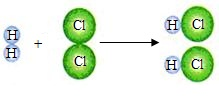

 15、镁在空气中燃烧,生成氧化镁,其固体质量变化如右图所示,则 固(80-48)g表示的质量是
15、镁在空气中燃烧,生成氧化镁,其固体质量变化如右图所示,则 固(80-48)g表示的质量是