题目内容
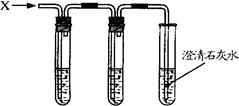
(6分)小伟利用下图所示装置进行系列探究活动。从分液漏斗依次向集气瓶中加入①适量滴有酚酞的氢氧化钠溶液;②过量的氢氧化钙溶液;③一定量的稀盐酸。回答下列问题:

(1)实验①发生反应的化学方程式为 。
(2)实验②的探究目的是 。
(3)整个实验过程中,酚酞起到的作用是 。
(4)实验③结束时,集气瓶内溶液澄清,则溶液中溶质的组成可能是 (写其中的一种),确定该组成的方法是 。

(1)实验①发生反应的化学方程式为 。
(2)实验②的探究目的是 。
(3)整个实验过程中,酚酞起到的作用是 。
(4)实验③结束时,集气瓶内溶液澄清,则溶液中溶质的组成可能是 (写其中的一种),确定该组成的方法是 。
(1)2NaOH + CO2 = Na2CO3 + H2O
(2)探究碱和盐能否发生复分解反应
(3)判定酸和碱能发生中和反应
(4)NaCl、CaCl2、HCl、酚酞;取少量该溶液于试管中,滴加碳酸钠溶液,若有气泡产生,则溶液中的溶质为NaCl、CaCl2、HCl、酚酞;若无气泡产生,溶液中的溶质为NaCl、CaCl2、酚酞。
(2)探究碱和盐能否发生复分解反应
(3)判定酸和碱能发生中和反应
(4)NaCl、CaCl2、HCl、酚酞;取少量该溶液于试管中,滴加碳酸钠溶液,若有气泡产生,则溶液中的溶质为NaCl、CaCl2、HCl、酚酞;若无气泡产生,溶液中的溶质为NaCl、CaCl2、酚酞。
试题分析:(1)氢氧化钠和二氧化碳反应生成碳酸钠和水,故反应的化学方程式为2NaOH+CO2=Na2CO3+H2O;
(2)由于①中反应生成的碳酸钠会与②氢氧化钙反应生成碳酸钙沉淀,故可用来证明碱和盐发生了反应,所以实验②的探究目的是:探究碱和盐能否发生复分解反应;
(3)由于②氢氧化钙是过量的,故与碳酸钠反应后有剩余,会与加入的③一定量的稀盐酸反应,但二者反应没有现象,故需借助指示剂;由于碱能使酚酞变红色,故当酚酞变成无色时,说明溶液中的碱反应完了,也就证明发生了酸碱中和反应;
(4)①二氧化碳和氢氧化钠反应生成了碳酸钠和水,②过量的氢氧化钙会与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,③一定量的盐酸会与剩余的氢氧化钙反应生成氯化钙和水,会与碳酸钙沉淀反应生成氯化钙、水和二氧化碳,也会与氢氧化钠反应生成氯化钠和水,所以反应后的溶质可能有:氯化钠、氯化钙、氯化氢和酚酞;
通过①②③的反应可知,溶液中一定存在氯化钠、氯化钙和酚酞三种物质,至于盐酸的是否存在,可选用碳酸钠来检验:取少量该溶液于试管中,滴加碳酸钠溶液,若有气泡产生,则溶液中的溶质为NaCl、CaCl2、HCl和酚酞;若无气泡产生,溶液中的溶质为NaCl、CaCl2和酚酞。
点评:在解此类题时,首先要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律。

练习册系列答案
相关题目
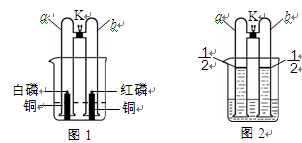
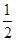 体积的氢气于两管中。再将镁条和大理石分别置于a、b管口内,向烧杯内逐滴加入浓盐酸,a、b管内均有气泡产生,其中a管反应的化学方程式是 。待两管内液体恰好全部排出后,向烧杯中加入过量的浓氢氧化钠溶液,溶液变浑浊。一段时间后,打开K,此时观察到a、b管中的现象是 。
体积的氢气于两管中。再将镁条和大理石分别置于a、b管口内,向烧杯内逐滴加入浓盐酸,a、b管内均有气泡产生,其中a管反应的化学方程式是 。待两管内液体恰好全部排出后,向烧杯中加入过量的浓氢氧化钠溶液,溶液变浑浊。一段时间后,打开K,此时观察到a、b管中的现象是 。

 (1)A实验在集气瓶中预先装入少量水的目的是 。
(1)A实验在集气瓶中预先装入少量水的目的是 。