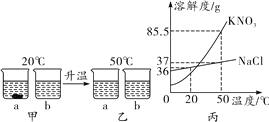
题目内容
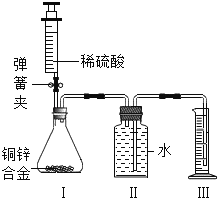
【题目】人们曾用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题.
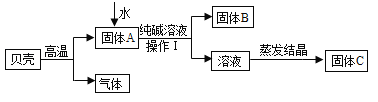
(1)贝壳高温煅烧时,发生反应的化学方程式是___________________________.
(2)水加入到固体A中的反应是______(填“吸热”或“放热”),操作Ⅰ中用到的玻璃仪器有烧杯、______、玻璃棒;将溶液蒸发结晶至______时停止加热.
(3)将固体C配成溶液,其溶液中一定含有的溶质是______(填化学式),下列不属于该物质的用途的是______.(填字母序号)
A 造纸 B 制造肥皂 C 治疗胃酸过多 D 去油污
【答案】CaCO3 ![]() CaO+CO2↑ 放热 漏斗 有较多晶体析出 NaOH C
CaO+CO2↑ 放热 漏斗 有较多晶体析出 NaOH C
【解析】
碳酸钙高温分解生成氧化钙和二氧化碳,方程式是:CaCO3高温CaO+CO2↑;故答案为:CaCO3高温CaO+CO2↑;
(2)固体A为氧化钙,溶于水生成熟石灰,该反应是放热反应,由于熟石灰微溶于水,所以形成的为悬浊液;操作Ⅰ是将不溶水的固体物质与液体分离,符合过滤的特点,故此操为过滤,过滤用到的玻璃仪器有:烧杯、漏斗、玻璃棒;将溶液蒸发结晶至产生大量固体时停止加热;
故答案为:放热;漏斗;产生大量固体;
(3)氢氧化钙溶液与纯碱溶液反应生成碳酸钙沉淀和氢氧化钠,碳酸钙为沉淀不能做溶质,只能是氢氧化钠做溶质;而反应物不知是否过量,所以氢氧化钙或碳酸钠只能是可能存在,所以溶液中一定含有的溶质是氢氧化钠,化学式为NaOH,氢氧化钠的用途:造纸、制肥皂、去油污,氢氧化钠具有腐蚀性,不能用于治疗胃酸过多,故选C;
故答案为:NaOH;C。

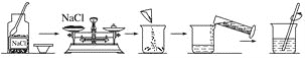
【题目】“卓筒井”是手工制盐的活化石,是我国古代劳动人民勤劳、智慧的象征。其工艺流程包括下面五个步骤:钻井→汲卤→晒卤→滤卤→煎盐。请回答下列问题:
(1)上述步骤中,_____与实验室过滤的原理一样,“煎盐”和实验室_____结晶的原理相同。
(2)“汲卤”获得卤水主要成分是氯化钠与氯化钾,卤水中氯化钠的质量分数大约为 7%~10%,“晒卤”目的是_____;“煎盐”得到的食盐中含有氯化钾,实验室可用_____检验,操作方法是_____。
(3)下列数据是氯化钠和氯化钾固体在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度 g/100g 水 | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | |
根据表中数据可得出:40℃时,氯化钠溶解度_____氯化钾溶解度(填:大于、小于、等于); 氯化钠与氯化钾溶解度相同的温度范围是_____;20℃时,100g 卤水氯化钠的质量分数为 9%,含氯化钾 1.00g,蒸发掉水大于_____g,开始有氯化钠析出。