题目内容
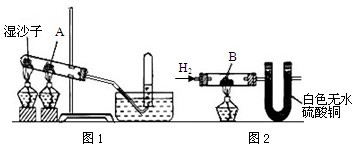
图1中的A为一种常见的金属单质的黑色粉末,实验时先预热试管再加热A物质,过一会儿加热湿沙子,实验收集的气体为H2,原A物质已变成了化合物B,但仍为黑色,并能被磁铁吸引.
(1)请认真分析后指出:
A物质的化学式为:______;化学方程式为______ Fe3O4+4H2↑
【答案】分析:通过物质的颜色和性质判断物质的种类;根据金属活动顺序表中镁、铁、铜的金属活动性强弱去作答,这三种金属的金属活动性由强到弱的顺序为镁>铁>铜.
解答:解:(1)能被磁铁吸引的化合物B只有Fe3O4,因为其由金属单质A反应生成,则A物质为铁.加热湿沙子会生成水蒸气,铁在加热的条件下与水和氧气反应可制的氢气.故答案为:Fe、3Fe+4H2O(气) Fe3O4+4H2↑
Fe3O4+4H2↑
(2)白色无水硫酸铜粉末变为蓝色,说明有水生成;黑色化合物B又变成了物质A,即通入的H2把Fe3O4还原为Fe.故答案为:Fe3O4+4H2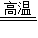 3Fe+4H2O
3Fe+4H2O
(3)要证明镁、铁、铜的金属活动性顺序,可利用镁能把铁在它的盐溶液中置换出来,而铜不能把铁在它的盐溶液中置换出来的原理;或利用铁能把铜铁在它的盐溶液中置换出来,而铁不能把镁在它的盐溶液中置换出来的原理.故答案为:Mg、FeSO4溶液、Cu
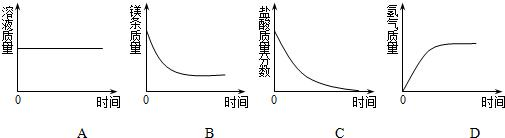
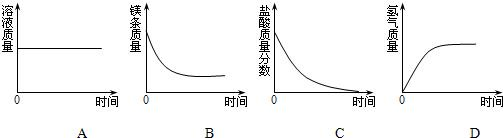
(4)镁与稀盐酸反应生成氯化镁和氢气.
A、反应后,有24份质量的镁进入溶液,有2份质量的氢气从溶液中被置换出来,因此溶液增加了22份质量,即溶液质量增加.所以A错误
B、稀盐酸过量,镁完全反应,故反应后镁的质量为零.所以B错误
C、稀盐酸过量,反应后盐酸有剩余,因此其溶质质量分数不为零.所以C错误
D、反应前无氢气生成,其起点为零;随反应进行,氢气质量逐渐增加;当镁完全反应时,氢气质量不再增加.所以D正确
故选D.
点评:同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.前边的金属会把后边的金属从其盐溶液中置换出来,后边的金属不能把前边的金属从其盐溶液中置换出来.
解答:解:(1)能被磁铁吸引的化合物B只有Fe3O4,因为其由金属单质A反应生成,则A物质为铁.加热湿沙子会生成水蒸气,铁在加热的条件下与水和氧气反应可制的氢气.故答案为:Fe、3Fe+4H2O(气)
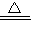 Fe3O4+4H2↑
Fe3O4+4H2↑(2)白色无水硫酸铜粉末变为蓝色,说明有水生成;黑色化合物B又变成了物质A,即通入的H2把Fe3O4还原为Fe.故答案为:Fe3O4+4H2
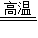 3Fe+4H2O
3Fe+4H2O(3)要证明镁、铁、铜的金属活动性顺序,可利用镁能把铁在它的盐溶液中置换出来,而铜不能把铁在它的盐溶液中置换出来的原理;或利用铁能把铜铁在它的盐溶液中置换出来,而铁不能把镁在它的盐溶液中置换出来的原理.故答案为:Mg、FeSO4溶液、Cu
(4)镁与稀盐酸反应生成氯化镁和氢气.
A、反应后,有24份质量的镁进入溶液,有2份质量的氢气从溶液中被置换出来,因此溶液增加了22份质量,即溶液质量增加.所以A错误
B、稀盐酸过量,镁完全反应,故反应后镁的质量为零.所以B错误
C、稀盐酸过量,反应后盐酸有剩余,因此其溶质质量分数不为零.所以C错误
D、反应前无氢气生成,其起点为零;随反应进行,氢气质量逐渐增加;当镁完全反应时,氢气质量不再增加.所以D正确
故选D.
点评:同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.前边的金属会把后边的金属从其盐溶液中置换出来,后边的金属不能把前边的金属从其盐溶液中置换出来.

练习册系列答案
相关题目