题目内容
【题目】请回答下列实验问题:
(1)现提供下列装置
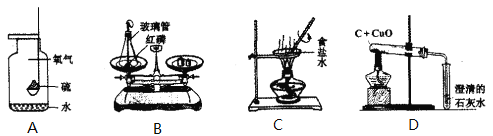
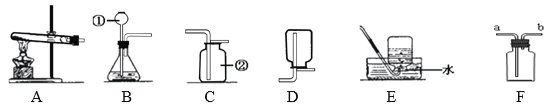
①上图C装置中,甲仪器的名称是__________。
②实验室将双氧水加入二氧化锰粉末制取氧气,发生装置是____(填序号),反应的化学方程式为_____________,若用E装置收集氧气,当有______________时,开始收集气体。
③实验室可以按照“B→F→F→真空气囊”的装置顺序制取纯净的CO2气体,B装置中发生反应的化学方程式为___________________,第一个F装置盛放试剂的作用是__________,第二个F装置盛放的试剂为______________。
(2)实验室用氯化钠固体配制50g15%的氯化钠溶液的步骤有:计算、称取氯化钠、量取水、溶解、转移。
①在溶解过程中,玻璃棒的作用是_____________________。
②下列操作中,可能导致配制氯化钠溶液的溶质质量分数偏大的是_______(填序号)。
a.称取时,将氯化钠置于托盘天平的右盘
b.量取水时俯视读数
c.用已有少量水的烧杯溶解氯化钠
d.转移时,有少量溶液溅出
【答案】 长颈漏斗 B 2H2O2 MnO2 2H2O+O2↑ 气泡连续不断均匀放出 CaCO3+2HCl=CaCl2+H2O+CO2↑ 吸收挥发出来的氯化氢气体 浓硫酸 搅拌加速溶解 b
【解析】(1). ①图C装置中,甲仪器的名称是长颈漏斗。② B,固体和液体反应不需加热制取气体;2H2O2 MnO2 2H2O+O2↑;若用E装置收集氧气,当有气泡连续不断均匀放出,此时收集到的氧气比较纯净。③实验室可以按照“B→F→F→真空气囊”的装置顺序制取纯净的CO2气体,B装置中发生反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;第一个F装置盛放试剂的作用是吸收挥发出来的氯化氢气体,可以盛放饱和碳酸氢钠溶液,与二氧化碳不反应,与盐酸反应生成二氧化碳,第二个F装置盛放的试剂为浓硫酸,浓硫酸具有吸水性。(2)实验室用氯化钠固体配制50g15%的氯化钠溶液的步骤有:计算、称取氯化钠、量取水、溶解、转移。①在溶解过程中,玻璃棒的作用是搅拌加速溶解速率。②可能导致配制氯化钠溶液的溶质质量分数偏大的是b,量筒俯视读数比实际大。
点睛∶配制一定质量一定溶质质量分数的氯化钠溶液的步骤有:计算、称取氯化钠、量取水、溶解、转移。量筒读数应平视。根据反应物状态和反应条件选择气体制取装置,根据生成物气体的溶解性和密度选择气体的收集方法。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。

实验次数 | 1 | 2 | 3 |
碳酸钠质量/克 | 0.53 | 1.06 | 2.12 |
反应前装置总质量/克 | 66.33 | 66.86 | 67.92 |
反应后装置总质量/克 | 66.19 | 66.62 | 67.42 |
(1)计算第1次反应产生的二氧化碳质量为______________。
(2)分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律______________。(空气密度取1.3克/升,二氧化碳密度取2.0克/升,结果精确到0.01)
【题目】多彩的“碳”,多姿的生活,让我们一起走进“碳”的世界.
(1)根据表1提供的信息,填写有关含碳物质的对应特性.
物质用途 | 金刚石切割玻璃 | 石墨作电极 | 活性炭净水 |
对应性质 | ①______ | ②______ | ③______ |
(2)二氧化碳是宝贵的资源.在高温高压下,CO2和NH3可以合成尿素[CO(NH2)2],同时生成水.该反应的化学方程式为_________.
(3)目前,人类以化石燃料为主要能源.化石燃料有煤、石油和天然气,天然气中甲烷完全燃烧生成二氧化碳和水,甲烷中一定含有____元素.
(4)从表2数据分析,与煤相比,用天然气作燃料的优点有______.
1g物质完全燃烧 | ||
产生二氧化碳的质量/g | 放出的热量/kJ | |
甲烷 | 2.75 | 56 |
碳 | 3.67 | 32 |