题目内容
【题目】往100 g硫酸和硫酸铜的混合液中,逐滴加入8%的氢氧化钠溶液直至过量,根据实验事实绘制了如图所示曲线,分析并计算:
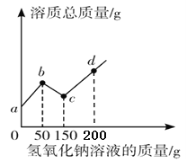
(1)a →b段表示氢氧化钠与混合物中的_________发生反应。
(2)求反应前混合液中硫酸铜的质量分数____________(写出计算过程)。
(3)完全反应时所得到的溶液中溶质的质量分数为_______________。
【答案】硫酸 16% 8.9%
【解析】
根据溶质的变化可以看出,ab段是硫酸和氢氧化钠的反应,而bc段是氢氧化钠和硫酸铜反应,cd为氢氧化钠过量。据此分析和计算。
解:(1)根据溶质的变化可以看出,ab段是硫酸和氢氧化钠的反应,所以a→b段表示氢氧化钠与混合物中的硫酸发生反应;
(2)根据图,可以看出与硫酸铜反应的氢氧化钠溶液的质量为150g-50g=100g,设反应前混合液中硫酸铜的质量分数为x,生成氢氧化铜的质量为y,
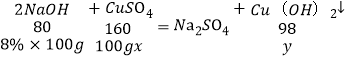
![]() x=16%,
x=16%,
![]() y= 9.8g,
y= 9.8g,
(3)据图可知完全反应时,参加反应氢氧化钠溶液的质量为150g,ab段是硫酸和氢氧化钠的反应,反应的化学方程为:2NaOH+H2SO4=Na2SO4+2H2O;c段是氢氧化钠和硫酸铜反应,反应的化学方程为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓;设反应生成的硫酸钠的质量为z,由元素守恒,可得出如下关系式:
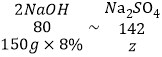
![]()
z=21.3g,
完全反应时所得到的溶液中溶质的质量分数为:![]() 100%≈8.9%。
100%≈8.9%。

【题目】小明同学欲通过实验证明二氧化锰是氯酸钾受热分解的催化剂.他设计并完成了下表所示的探究实验
实验操作 | 实验现象 | 实验结论或总结 | ||
实验结论 | 实验总结 | |||
实验一 | 氯酸钾在试管中加热, ①融化前伸入带火星的木条; ②融化后继续加热,再伸入带火星的木条, | ①木条不复燃 ②木条复燃 | 氯酸钾加热产生氧气反应的化学方程式为:________________ | 二氧化锰是氯酸钾受热分解的催化剂 |
实验二 | 加热二氧化锰,伸入带火星的木条, | 木条不复燃 | 二氧化锰受热不产生氧气. | |
实验三 | 木条迅速复燃 | 二氧化锰能加快氯酸钾的分解 | ||
(1)请你帮小明同学填写上表中未填完的空格;
(2)实验一中①②说明了什么?_____.
(3)在小明的探究实验中,实验一和实验二的作用是_____.
(4)小英同学认为仅由上述实验还不能完全得出表内“总结”,她补充设计了两个探究实验,最终通过实验,完整地证明了二氧化锰是氯酸钾受热分解的催化剂.第一个的实验操作中包含了两次称量,其目的是:_____;第二个的实验是要_____.
【题目】现有25g石灰石样品,请按下面要求计算
(1)25g样品与足量的稀盐酸反应放出8.8gCO2(杂质不溶于酸,且不与酸反应),请计算该样品的纯度(CaCO3的质量分数)是多少?_____
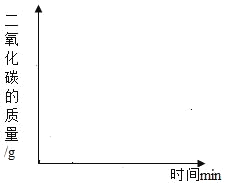
(2)若将25g样品平均分成两份,分别加工成块状和粉末状,将两份样品分别放入锥形瓶中,同时加入相同体积,相同浓度的足量稀盐酸充分反应,请在图象上画出块状样品和粉末状与稀盐酸反应放出CO2的曲线示意图。_____
(3)若将一定质量的该石灰石样品高温煅烧,有关物质质量反应时间的变化如表所示:
时间/min | t1 | t2 | t3 | t4 | t5 |
CO2质量/g | 2.2 | 4.4 | 6.6 | 8.8 | 8.8 |
剩余固体质量/g | 22.8 | 20.6 | m | 16.2 | 16.2 |
则m=_____,t3时剩余固体中除杂质外含有的物质是_____(填化学式)