题目内容
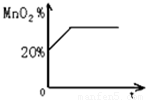
 实验室中加热氯酸钾和二氧化锰的混合物可制得氧气,在制备过程中,MnO2在混合物中的质量分数随加热时间的变化图象如图所示.
实验室中加热氯酸钾和二氧化锰的混合物可制得氧气,在制备过程中,MnO2在混合物中的质量分数随加热时间的变化图象如图所示.
(1)当MnO2的质量分数达到多少时不再产生氧气?
(2)当反应完毕后剩余固体的质量为10.5g,则产生氧气多少克?
解:(1)假设反应前混合物的质量为100g,则二氧化锰的质量为20g,氯酸钾的质量为80g.
设80g氯酸钾完全反应生成氯化钾的质量为x
2KClO3 2KCl+3O2↑
2KCl+3O2↑
245 149
80g x
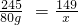
解得:x=48.7g
所以反应后二氧化锰的质量分数为: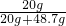 ×100%=29%;
×100%=29%;
(2)若剩余固体的质量为10.5g,则可以知道生成氯化钾的质量为:10.5g×(1-29%)=7.46g
设可生成氧气的质量为y,则:
2KClO3 2KCl+3O2↑
2KCl+3O2↑
149 96
7.46g y
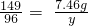
解得:y=4.8g
答:(1)当MnO2的质量分数达到29%时不再产生氧气;
(2)当反应完毕后剩余固体的质量为10.5g,则产生氧气4.8克.
分析:(1)由于反应开始时二氧化锰的质量分数为20%,所以可假设开始氯酸钾和二氧化锰的质量之和100g,那么氯酸钾的质量为80g,然后根据氯酸钾受热分解的化学方程式,利用氯酸钾的质量求出反应后生成氯化钾的质量,进而求出反应后二氧化锰的质量分数;
(2)根据(1)的解答根据反应后的二氧化锰的质量分数来进行解答.
点评:此题是利用化学方程式的计算,此题没给任何物质质量的具体数值,给此题的计算加深了难度.
设80g氯酸钾完全反应生成氯化钾的质量为x
2KClO3
 2KCl+3O2↑
2KCl+3O2↑245 149
80g x
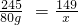
解得:x=48.7g
所以反应后二氧化锰的质量分数为:
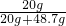 ×100%=29%;
×100%=29%;(2)若剩余固体的质量为10.5g,则可以知道生成氯化钾的质量为:10.5g×(1-29%)=7.46g
设可生成氧气的质量为y,则:
2KClO3
 2KCl+3O2↑
2KCl+3O2↑149 96
7.46g y
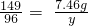
解得:y=4.8g
答:(1)当MnO2的质量分数达到29%时不再产生氧气;
(2)当反应完毕后剩余固体的质量为10.5g,则产生氧气4.8克.
分析:(1)由于反应开始时二氧化锰的质量分数为20%,所以可假设开始氯酸钾和二氧化锰的质量之和100g,那么氯酸钾的质量为80g,然后根据氯酸钾受热分解的化学方程式,利用氯酸钾的质量求出反应后生成氯化钾的质量,进而求出反应后二氧化锰的质量分数;
(2)根据(1)的解答根据反应后的二氧化锰的质量分数来进行解答.
点评:此题是利用化学方程式的计算,此题没给任何物质质量的具体数值,给此题的计算加深了难度.

练习册系列答案
相关题目
 实验室中加热氯酸钾和二氧化锰的混合物可制得氧气,在制备过程中,MnO2在混合物中的质量分数随加热时间的变化图象如图所示.
实验室中加热氯酸钾和二氧化锰的混合物可制得氧气,在制备过程中,MnO2在混合物中的质量分数随加热时间的变化图象如图所示.