题目内容
(2010?宣武区二模)据图回答问题.
(1)10℃时,在“图一”饱和溶液中溶质的质量分数最大的是(填a、b和c).在t℃时,m点代表的含义是.
(2)室温时,在“图二”中可能为不饱和溶液的是(填“烧杯”、“试管1”或“试管2”).
(3)把“图二”中室温时的甲、乙、丙三种物质的溶液升温到80℃时,发现烧杯中甲物质没有明显变化,乙物质全部溶解,试管2中有丙物质析出.根据现象回答问题:
①在“图一”中能表示丙物质的溶解度曲线的是(选填“a”、“b”或“c”).
②若乙物质的溶液中溶有少量的甲物质,提纯乙的方法是.
③若把试管1从烧杯中取出、冷却至室温后,从溶液中析出的固体质量为g.(析出的物质不含结晶水)
【答案】分析:根据固体物质的溶解度曲线可知:①比较不同物质在同一温度下的溶解度的大小;
②判断物质的溶解度随温度变化的变化情况,如:将室温时的甲、乙、丙三种物质的溶液升温到80℃时,发现烧杯中甲物质没有明显变化,说明甲的溶解度受温度的影响很小,因此代表甲的溶解度曲线的是b;
③判断通过降温还是蒸发溶剂的方法来提纯物质;
④判断一定质量的饱和溶液降温结晶时析出晶体的多少.注意溶解度和同温度下的饱和溶液中溶质的质量分数间的关系:饱和溶液中溶质的质量分数= ×100%.
×100%.
解答:解:(1)由于在10℃时,三物质的溶解度曲线大小关系是b>a>c,因此饱和溶液中溶质的质量分数大小关系是b>a>c;在t℃时,a和b的溶解度曲线交于m点,说明在t℃时,a和b的溶解度相等;故答案为:b,在t℃时,a和b的溶解度相等
(2)由于从图中不难看出,甲和乙都没有全部溶解,而只有丙全部溶解,说明可能为不饱和溶液的为丙溶液,故答案为:试管2
(3)把室温时的甲、乙、丙三种物质的溶液升温到80℃时,发现烧杯中甲物质没有明显变化,乙物质全部溶解,试管2中有丙物质析出,说明甲的溶解度受温度的影响很小,乙的溶解度随温度的升高而增大,丙的溶解度随温度的升高而减小,因此代表甲的溶解度曲线的是b,代表乙的溶解度曲线的是a,代表丙的溶解度曲线的是c,故答案为:①c
②由于甲的溶解度受温度的影响很小,乙的溶解度随温度的升高而增大,因此提纯含有少量甲的乙,应采取降温的方法,故答案为:降温
③由于试管1中的物质经过升温后又恢复到原来的温度,因此溶液中的量还和原来一样,故析出的晶体的质量就是原来未溶解的固体的质量,故答案为:1
点评:本题难度不是很大,主要考查了溶解度曲线所表示的意义及根据溶解度曲线解决一系列的问题,培养学生解决问题的能力.
②判断物质的溶解度随温度变化的变化情况,如:将室温时的甲、乙、丙三种物质的溶液升温到80℃时,发现烧杯中甲物质没有明显变化,说明甲的溶解度受温度的影响很小,因此代表甲的溶解度曲线的是b;
③判断通过降温还是蒸发溶剂的方法来提纯物质;
④判断一定质量的饱和溶液降温结晶时析出晶体的多少.注意溶解度和同温度下的饱和溶液中溶质的质量分数间的关系:饱和溶液中溶质的质量分数=
 ×100%.
×100%.解答:解:(1)由于在10℃时,三物质的溶解度曲线大小关系是b>a>c,因此饱和溶液中溶质的质量分数大小关系是b>a>c;在t℃时,a和b的溶解度曲线交于m点,说明在t℃时,a和b的溶解度相等;故答案为:b,在t℃时,a和b的溶解度相等
(2)由于从图中不难看出,甲和乙都没有全部溶解,而只有丙全部溶解,说明可能为不饱和溶液的为丙溶液,故答案为:试管2
(3)把室温时的甲、乙、丙三种物质的溶液升温到80℃时,发现烧杯中甲物质没有明显变化,乙物质全部溶解,试管2中有丙物质析出,说明甲的溶解度受温度的影响很小,乙的溶解度随温度的升高而增大,丙的溶解度随温度的升高而减小,因此代表甲的溶解度曲线的是b,代表乙的溶解度曲线的是a,代表丙的溶解度曲线的是c,故答案为:①c
②由于甲的溶解度受温度的影响很小,乙的溶解度随温度的升高而增大,因此提纯含有少量甲的乙,应采取降温的方法,故答案为:降温
③由于试管1中的物质经过升温后又恢复到原来的温度,因此溶液中的量还和原来一样,故析出的晶体的质量就是原来未溶解的固体的质量,故答案为:1
点评:本题难度不是很大,主要考查了溶解度曲线所表示的意义及根据溶解度曲线解决一系列的问题,培养学生解决问题的能力.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
(2010?宣武区二模)小熠同学为补充维生素服用XX牌多维元素片,该药品标签如图所示,请你计算:
(1)小刚同学按标签所示方法服用该药片,则每天服用的维生素C为______mg;
(2)维生素B2的相对分子质量为______;其中氢、氧元素的质量比为______.
| ××牌多维元素片 [成分]本品每片内含 维生素B2[C17H20N4O6]:2.5mg 维生素C[C6H8O6]:25.0mg 维生素E[C29H50O2]:5.0mg [用法用量]口服,一日2片 |
(2)维生素B2的相对分子质量为______;其中氢、氧元素的质量比为______.
(2010?宣武区二模)小熠同学为补充维生素服用XX牌多维元素片,该药品标签如图所示,请你计算:
(1)小刚同学按标签所示方法服用该药片,则每天服用的维生素C为______mg;
(2)维生素B2的相对分子质量为______;其中氢、氧元素的质量比为______.
| ××牌多维元素片 [成分]本品每片内含 维生素B2[C17H20N4O6]:2.5mg 维生素C[C6H8O6]:25.0mg 维生素E[C29H50O2]:5.0mg [用法用量]口服,一日2片 |
(2)维生素B2的相对分子质量为______;其中氢、氧元素的质量比为______.
(2010?宣武区二模)小熠同学为补充维生素服用XX牌多维元素片,该药品标签如图所示,请你计算:
(1)小刚同学按标签所示方法服用该药片,则每天服用的维生素C为______mg;
(2)维生素B2的相对分子质量为______;其中氢、氧元素的质量比为______.
| ××牌多维元素片 [成分]本品每片内含 维生素B2[C17H20N4O6]:2.5mg 维生素C[C6H8O6]:25.0mg 维生素E[C29H50O2]:5.0mg [用法用量]口服,一日2片 |
(2)维生素B2的相对分子质量为______;其中氢、氧元素的质量比为______.
(2010?宣武区二模)某同学从物质类别的角度构建了如“图一”所示的知识网络图,借助网络图回答:
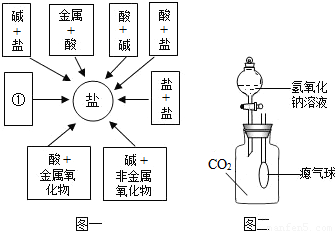
(1)写出用酸和碱生成氯化钠的化学方程式______.
(2)请把图中①处补充完整,要求不能与图中已有信息重复.
①是______.
(3)某小组尝试做了“碱与非金属氧化物”的反应实验(实验装置见图二).
[实验现象]气球膨胀.
[实验验证]为了进一步验证有无新物质生成,甲和丙两位同学分别取少量的“图二”中反应后的溶液于试管中,并按各自的实验方案进行实验.
1、甲同学向试管中滴入酚酞溶液,发现溶液变成红色,证明有新物质生成.乙同学认为甲同学的结论不正确,他的理由是______.
2、乙同学提出新的验证方案,请你帮助乙同学完成验证报告.
3、丙同学向另一只试管中加入一定量的氢氧化钙溶液,发现白色沉淀生成,证明生成了新物质.
4、丙同学将反应后的滤液倒入乙同学的废液中,充分混合后无明显现象.混合后的溶液中除含有酚酞外,还可能含有的溶质是:A NaCl; B NaCl和CaCl2; C______;D______.

(1)写出用酸和碱生成氯化钠的化学方程式______.
(2)请把图中①处补充完整,要求不能与图中已有信息重复.
①是______.
(3)某小组尝试做了“碱与非金属氧化物”的反应实验(实验装置见图二).
[实验现象]气球膨胀.
[实验验证]为了进一步验证有无新物质生成,甲和丙两位同学分别取少量的“图二”中反应后的溶液于试管中,并按各自的实验方案进行实验.
1、甲同学向试管中滴入酚酞溶液,发现溶液变成红色,证明有新物质生成.乙同学认为甲同学的结论不正确,他的理由是______.
2、乙同学提出新的验证方案,请你帮助乙同学完成验证报告.
| 步骤 | 现象 | 结论 |
| 向甲同学实验后的溶液中滴加过量的稀盐酸 | 有气体生成、________________ | 氢氧化钠与二氧化碳发生反应 |
4、丙同学将反应后的滤液倒入乙同学的废液中,充分混合后无明显现象.混合后的溶液中除含有酚酞外,还可能含有的溶质是:A NaCl; B NaCl和CaCl2; C______;D______.
 B、
B、 C、
C、