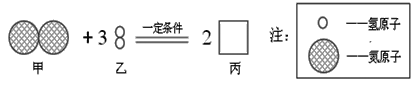
题目内容
【题目】汽车的使用是人类进步的标志,但生产汽车的材料、使用的能源等是人们关注并需解决的问题。
(1)制造汽车的材料以钢铁为主,钢是_______的合金;写出在高温下碳与氧化铁反应的化学方程式:_______________________________________。
(2)钢铁的防腐是汽车制造业研究的重要课题之一。铁生锈的原因是___________。
(3)有些汽车新型排气系统中,使用抗腐蚀性能好的钛合金材料。生产钛(Ti)的部分工艺流程图如下:

回答以下问题:
①二氧化钛中钛元素的化合价为_______。
②写出镁与四氯化钛(TiCl4)发生反应的化学方程式:____________________________;该反应类型属于___________。上述反应需在氩气环境中进行,理由是_____________。
(4)家用汽车和公交车相比,前者的耗油量大约是后者的1/5左右。前者和后者在行驶时所排出的污染物的比率大致也是1/5左右。如果后者载运乘客量平均为50人,前者平均为2人,请对比它们在燃料利用和污染环境方面等因素,你的建议是_______。
【答案】 铁和碳 2Fe2O3+3C![]() 4Fe+3CO2
4Fe+3CO2![]() 铁与空气中的氧气、水蒸气等发生化学反应 +4 2Mg+TiCl4
铁与空气中的氧气、水蒸气等发生化学反应 +4 2Mg+TiCl4![]() Ti+2MgCl2 置换反应 防止高温下Mg(或Ti)被氧化 发展公共交通(合理答案均可)
Ti+2MgCl2 置换反应 防止高温下Mg(或Ti)被氧化 发展公共交通(合理答案均可)
【解析】钢是铁的合金,是指铁中含有少量的碳;高温下碳与氧化铁反应的化学方程式为:2Fe2O3+3C 高温4Fe+3CO2![]() ;(2)铁在潮湿的空气中易与空气中的氧气、水蒸气等发生化学反应使铁变质;(3)①二氧化钛中各元素的化合价的代数和为0,已知氧元素的化合价为-2价,设钛元素的化合价为x,则x+(-2)
;(2)铁在潮湿的空气中易与空气中的氧气、水蒸气等发生化学反应使铁变质;(3)①二氧化钛中各元素的化合价的代数和为0,已知氧元素的化合价为-2价,设钛元素的化合价为x,则x+(-2)![]() 2=0,得x=+4,故二氧化钛中钛元素的化合价为+4;②镁与四氯化钛(TiCl4)发生反应的化学方程式为:2Mg+ TiCl4高温Ti+2Mg Cl2;该反应是由一种单质和一种化合物反应生成另一种单质和另一种化合物,符合置换反应的特点,是分解反应;氩气是一种不活泼的气体,可以起到保护作用,该反应是在高温的条件下进行,氩气可以防止炽热的金属被氧化;(4)使用私家车污染大 、耗油高,推荐大家多乘坐公交车少开私家车。
2=0,得x=+4,故二氧化钛中钛元素的化合价为+4;②镁与四氯化钛(TiCl4)发生反应的化学方程式为:2Mg+ TiCl4高温Ti+2Mg Cl2;该反应是由一种单质和一种化合物反应生成另一种单质和另一种化合物,符合置换反应的特点,是分解反应;氩气是一种不活泼的气体,可以起到保护作用,该反应是在高温的条件下进行,氩气可以防止炽热的金属被氧化;(4)使用私家车污染大 、耗油高,推荐大家多乘坐公交车少开私家车。