题目内容
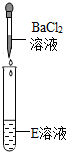
(2013?保山)有一包白色粉末.可能含有Ba(NO3)2,Na2SO4,Na2CO3,NaNO3中的一种或几种,某同学分析其成分做了如下实验.该同学分析正确是( )
|
分析:Ba(NO3)2,Na2SO4,Na2CO3,NaNO3中混合能够产生沉淀的是Ba(NO3)2和Na2SO4或Na2CO3的反应,且硫酸钡不溶于盐酸碳酸钡能够溶于盐酸据此分析解答;
解答:解:由于Ba(NO3)2,Na2SO4,Na2CO3,NaNO3中混合能够产生沉淀的是Ba(NO3)2和Na2SO4或Na2CO3的反应,且硫酸钡不溶于盐酸碳酸钡能够溶于盐酸,所以由步骤1可知该固体中含有能够生成沉淀的物质,而从步骤2可知生成的白色沉淀有能溶解与盐酸的也有不溶于盐酸的,故可知该固体中一定含有Ba(NO3)2、Na2SO4和Na2CO3,而硝酸钠是否含有无法判断;
故选D
故选D
点评:此类问题解决思路一般为:根据物质的性质及物质间可能发生的反应及反应时出现的现象,结合实验中所出现的现象,分析并判断混合物的组成.

练习册系列答案
相关题目