题目内容
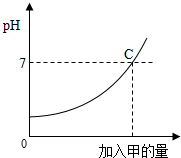 酸和碱作用生成盐和水的反应叫做中和反应.已知甲、乙分别是盐酸和氢氧化钠溶液中的一种,如图表示向M克溶质质量分数为a的乙溶液中加入甲时溶液pH的变化曲线.请完成下列问题:
酸和碱作用生成盐和水的反应叫做中和反应.已知甲、乙分别是盐酸和氢氧化钠溶液中的一种,如图表示向M克溶质质量分数为a的乙溶液中加入甲时溶液pH的变化曲线.请完成下列问题:(1)甲是
(2)要求c点溶液中溶质的质量分数,若知道加入甲溶液的
(3)若用b表示加入甲溶液的某一数据,试计算c点溶液中溶质的质量分数.(任选一个数据计算即可)
分析:(1)根据图象中pH值的变化是从小于7逐渐的增大到大于7,可以分析确定操作的过程,
(2)根据盐酸或氢氧化钠的质量求出恰好反应是溶质的质量;
(3)写出盐酸和氢氧化钠反应的化学方程式,根据已知的氢氧化钠的质量,求得反应后生成的氯化钠的质量,进而求得所得溶液的溶质质量分数.
(2)根据盐酸或氢氧化钠的质量求出恰好反应是溶质的质量;
(3)写出盐酸和氢氧化钠反应的化学方程式,根据已知的氢氧化钠的质量,求得反应后生成的氯化钠的质量,进而求得所得溶液的溶质质量分数.
解答:解:(1)由图象可知,pH值是从小于7 逐渐的增大到7然后在大于7,可知原溶液是酸性的,然后不断的加碱,使pH升高,故甲是氢氧化钠溶液;
(2)根据氢氧化钠的质量就可求出氯化钠的质量,所以氢氧化钠的质量是根据溶液的质量和溶质质量分数求出;
(3)若b表示加入氢氧化钠溶液的质量.
解:设生成NaCl的质量为x.
NaOH+HCl=NaCl+H2O
36.5 58.5
Mag x
=
x=
g
c点溶液中溶质质量分数=
× 100%=
%;
答:c点溶液中溶质的质量分数质量分数
%.
若b表示加入氢氧化钠溶液的溶质质量分数.
解:设生成NaCl的质量为x,加入氢氧化钠溶液的质量为y.
NaOH+HCl=NaCl+H2O
40 36.5 58.5
by Mag x
=
x=
g
=
y=
g
c点溶液中溶质质量分数=
× 100%=
%
答:c点溶液中溶质的质量分数
%.
故答案为:(1)氢氧化钠溶液;(2)质量;溶质质量分数;(3)
%;
%.
(2)根据氢氧化钠的质量就可求出氯化钠的质量,所以氢氧化钠的质量是根据溶液的质量和溶质质量分数求出;
(3)若b表示加入氢氧化钠溶液的质量.
解:设生成NaCl的质量为x.
NaOH+HCl=NaCl+H2O
36.5 58.5
Mag x
| 36.5 |
| Mag |
| 58.5 |
| x |
x=
| 58.5Ma |
| 36.5 |
c点溶液中溶质质量分数=
| ||
| (M+b)g |
| 5850Ma |
| 36.5(M+b) |
答:c点溶液中溶质的质量分数质量分数
| 5850Ma |
| 36.5(M+b) |
若b表示加入氢氧化钠溶液的溶质质量分数.
解:设生成NaCl的质量为x,加入氢氧化钠溶液的质量为y.
NaOH+HCl=NaCl+H2O
40 36.5 58.5
by Mag x
| 36.5 |
| Mag |
| 58.5 |
| x |
x=
| 58.5Ma |
| 36.5 |
| 40 |
| by |
| 36.5 |
| Mag |
y=
| 40Ma |
| 36.5b |
c点溶液中溶质质量分数=
| ||
(M+
|
| 5850ab |
| 36.5b+40a |
答:c点溶液中溶质的质量分数
| 5850ab |
| 36.5b+40a |
故答案为:(1)氢氧化钠溶液;(2)质量;溶质质量分数;(3)
| 5850Ma |
| 36.5(M+b) |
| 5850ab |
| 36.5b+40a |
点评:本题主要考查了从图象的角度对中和反应的正确理解,并进行相关的化学方程式的计算,要学会这种数形结合的思想.

练习册系列答案
相关题目
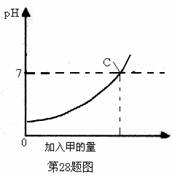
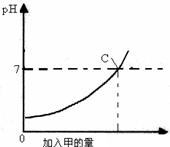 酸和碱作用生成盐和水的反应叫做中和反应.已知甲、乙分别是盐酸和氢氧化钠溶液中的一种,如图表示向M克溶质质量分数为a的乙溶液中加入甲时溶液pH的变化曲线.请完成下列问题:
酸和碱作用生成盐和水的反应叫做中和反应.已知甲、乙分别是盐酸和氢氧化钠溶液中的一种,如图表示向M克溶质质量分数为a的乙溶液中加入甲时溶液pH的变化曲线.请完成下列问题: