题目内容
实验室用5.2g锌与足量的稀硫酸反应,最多可制得氢气多少克?这些氢气在标准状况下的体积是多少升?(标准状况下氢气的密度为0.09g/L;计算结果精确到0.01)
解:设可制得氢气的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
5.2g x
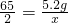
x= =0.16g
=0.16g
v═ ═
═ =1.78L
=1.78L
答:最多可制得氢气0.16g,这些氢气在标准状况下的体积是1.78L.
分析:首先应根据反应物、生成物、反应条件正确的写出化学方程式,然后根据方程式找出锌与氢气的质量关系,从而求出制得氢气的质量,再根据公式:体积═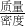 求出这些氢气的体积.
求出这些氢气的体积.
点评:本题是一道联系密度公式的综合学科题,考查了同学们用化学知识分析解决问题的能力.
Zn+H2SO4=ZnSO4+H2↑
65 2
5.2g x
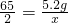
x=
 =0.16g
=0.16gv═
 ═
═ =1.78L
=1.78L答:最多可制得氢气0.16g,这些氢气在标准状况下的体积是1.78L.
分析:首先应根据反应物、生成物、反应条件正确的写出化学方程式,然后根据方程式找出锌与氢气的质量关系,从而求出制得氢气的质量,再根据公式:体积═
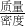 求出这些氢气的体积.
求出这些氢气的体积.点评:本题是一道联系密度公式的综合学科题,考查了同学们用化学知识分析解决问题的能力.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目