题目内容
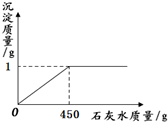 (2010?石景山区一模)取一定质量的氢氧化钠和碳酸钠混合物完全溶于水中,得到51g溶液,再向溶液中滴加石灰水,产生沉淀的质量与加入石灰水的质量关系如图所示.若氢氧化钠和碳酸钠混合物中钠元素的质量为0.92g.试计算:
(2010?石景山区一模)取一定质量的氢氧化钠和碳酸钠混合物完全溶于水中,得到51g溶液,再向溶液中滴加石灰水,产生沉淀的质量与加入石灰水的质量关系如图所示.若氢氧化钠和碳酸钠混合物中钠元素的质量为0.92g.试计算:(1)混合物中氢氧化钠的质量.
(2)恰好反应时,所得溶液中溶质的质量分数.
分析:(1)根据图中所示可以知道生成沉淀的质量为1g,即碳酸钙的质量为1g,可以根据化学方程式求算出碳酸钠的质量就,进而计算出其中钠元素的质量,然后就可以求算出氢氧化钠的质量;
(2)恰好反应后的溶液为氢氧化钠的溶液,注意氢氧化钠有两个来源:反应生成的和样品中含有的.
(2)恰好反应后的溶液为氢氧化钠的溶液,注意氢氧化钠有两个来源:反应生成的和样品中含有的.
解答:解:(1)设混合物中碳酸钠的质量为x,生成氢氧化钠的质量为y
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100 80
x 1 g y
=
=
解得:x=1.06g; y=0.8 g
1.06 g碳酸钠中钠元素的质量:
1.06 g×
×100%=0.46 g
混合物中氢氧化钠的质量:(0.92 g-0.46 g)÷
×100%=0.8 g
(2)所得溶液中氢氧化钠的质量分数:
×100%=0.32%
答:(1)混合物中氢氧化钠的质量为0.8g.
(2)恰好反应时,所得溶液中溶质的质量分数0.32%.
故答案为:
(1)0.8g;
(2)0.32%.
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100 80
x 1 g y
| 106 |
| x |
| 80 |
| y |
| 100 |
| 1g |
解得:x=1.06g; y=0.8 g
1.06 g碳酸钠中钠元素的质量:
1.06 g×
| 2×23 |
| 106 |
混合物中氢氧化钠的质量:(0.92 g-0.46 g)÷
| 23 |
| 40 |
(2)所得溶液中氢氧化钠的质量分数:
| 0.8g+0.8g |
| 51g+450g-1g |
答:(1)混合物中氢氧化钠的质量为0.8g.
(2)恰好反应时,所得溶液中溶质的质量分数0.32%.
故答案为:
(1)0.8g;
(2)0.32%.
点评:在对反应图象中曲线进行分析时,曲线的折点的意味着曲线所表示的反应在此时恰好完全反应,解答时要理清反应指所发生的反应,并正确的书写化学方程式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2010?石景山区一模)如图是某品牌化肥包装袋上的部分说明,该化肥属于( )
(2010?石景山区一模)如图是某品牌化肥包装袋上的部分说明,该化肥属于( ) (2010?石景山区二模)根据如图函数图象分析得出的下列结论中,正确的是( )
(2010?石景山区二模)根据如图函数图象分析得出的下列结论中,正确的是( )