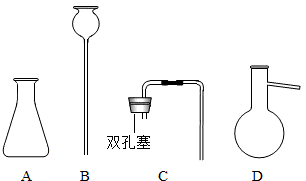
题目内容
 28、小军进行了下列实验:将数根火柴捆在一起,伸入到一集气瓶中,用另一根火柴点燃,等火柴头燃烧完后取出.迅速将集气瓶口与另一装有酸性KMnO4溶液的集气瓶瓶口对接,振荡,发现红色KMnO4溶液颜色消失.
28、小军进行了下列实验:将数根火柴捆在一起,伸入到一集气瓶中,用另一根火柴点燃,等火柴头燃烧完后取出.迅速将集气瓶口与另一装有酸性KMnO4溶液的集气瓶瓶口对接,振荡,发现红色KMnO4溶液颜色消失.查找资料:小钦从文献中查到:火柴头的主要成分为KClO3、硫磺粉(S)、三硫化二锑(Sb2S3)、玻璃粉等.
提出猜想:猜想1:生成的二氧化碳气体使高锰酸钾溶液褪色
猜想2:生成的二氧化氮气体使高锰酸钾溶液褪色
猜想3:生成的二氧化硫气体使高锰酸钾溶液褪色
小明从小钦查阅资料可以知道上述猜想 2错误,他的理由是:
反应物无氮元素,根据质量守恒定律,生成物一定无二氧化氮
实验探究1:于是小明对猜想1进行了探究:他在实验室制取二氧化碳,并将制得的CO2气体通入酸性高锰酸钾溶液中,发现酸性高锰酸钾溶液不褪色,他得出的结论是二氧化碳不会使高锰酸钾溶液褪色.
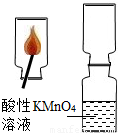
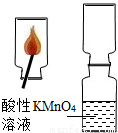
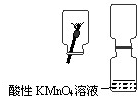
实验探究2:SO2气体是否可使酸性高锰酸钾溶液褪色
在老师的指导下,小刘同学先制取了二氧化硫,探究SO2气体是否可以使酸性KMnO4溶液褪色.
| 操作步骤 | 实验现象 | 结论 |
硫在氧气中燃烧
得到.分析:①由题意可知:“火柴头的主要成分为KClO3、硫磺粉(S)、三硫化二锑(Sb2S3)、玻璃粉等”,再根据质量守恒定律,可知:反应物无氮元素,则生成物一定无二氧化氮,故:生成的二氧化氮气体使高锰酸钾溶液褪色,故可推测猜想2不成立;
②实验探究1已验证:生成的二氧化碳气体使高锰酸钾溶液褪色,故推测猜想1不成立;
③由实验探究2:SO2气体是否可使酸性高锰酸钾溶液褪色,可推测猜想3:生成的二氧化硫气体使高锰酸钾溶液褪色.
②实验探究1已验证:生成的二氧化碳气体使高锰酸钾溶液褪色,故推测猜想1不成立;
③由实验探究2:SO2气体是否可使酸性高锰酸钾溶液褪色,可推测猜想3:生成的二氧化硫气体使高锰酸钾溶液褪色.
解答:解:①由题意可知:“火柴头的主要成分为KClO3、硫磺粉(S)、三硫化二锑(Sb2S3)、玻璃粉等”,并且根据质量守恒定律,可知:反应物无氮元素,则生成物一定无二氧化氮,故可推测“猜想2:生成的二氧化氮气体使高锰酸钾溶液褪色”不成立;
②由实验探究2:SO2气体是否可使酸性高锰酸钾溶液褪色:将制取好的二氧化硫气体通入高锰酸钾溶液中,观察高锰酸钾溶液褪色是否褪色.证明二氧化硫气体使高锰酸钾溶液褪色,故了推测猜想3正确.
故答为:反应物无氮元素,根据质量守恒定律,生成物一定无二氧化氮;
反思与评价:硫在氧气中燃烧
②由实验探究2:SO2气体是否可使酸性高锰酸钾溶液褪色:将制取好的二氧化硫气体通入高锰酸钾溶液中,观察高锰酸钾溶液褪色是否褪色.证明二氧化硫气体使高锰酸钾溶液褪色,故了推测猜想3正确.
故答为:反应物无氮元素,根据质量守恒定律,生成物一定无二氧化氮;
| 操作步骤 | 实验现象 | 结论 |
| 将制取好的二氧化硫气体通入高锰酸钾溶液中 | 高锰酸钾溶液褪色 | 二氧化硫气体使高锰酸钾溶液褪色 猜想3正确 |
点评:掌握利用质量守恒定律的元素守恒的思想处理问题;了解化学实验方案设计与评价的方法.

练习册系列答案
相关题目
 小军进行了下列实验:将数根火柴捆在一起,伸入到一集气瓶中,用另一根火柴点燃,等火柴头燃烧完后取出.迅速将集气瓶口与另一装有酸性KMnO4溶液的集气瓶瓶口对接,振荡,发现红色KMnO4溶液颜色消失.
小军进行了下列实验:将数根火柴捆在一起,伸入到一集气瓶中,用另一根火柴点燃,等火柴头燃烧完后取出.迅速将集气瓶口与另一装有酸性KMnO4溶液的集气瓶瓶口对接,振荡,发现红色KMnO4溶液颜色消失.
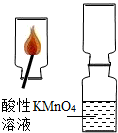 小军进行了下列实验:将数根火柴捆在一起,伸入到一集气瓶中,用另一根火柴点燃,等火柴头燃烧完后取出.迅速将集气瓶口与另一装有酸性KMnO4溶液的集气瓶瓶口对接,振荡,发现红色KMnO4溶液颜色消失.
小军进行了下列实验:将数根火柴捆在一起,伸入到一集气瓶中,用另一根火柴点燃,等火柴头燃烧完后取出.迅速将集气瓶口与另一装有酸性KMnO4溶液的集气瓶瓶口对接,振荡,发现红色KMnO4溶液颜色消失.