题目内容
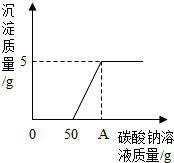 实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示.当滴入碳酸钠溶液至图中A点时,通过计算确定所得溶液是否为饱和溶液.(提示:20℃时,氯化钠溶解度为36克.)
实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示.当滴入碳酸钠溶液至图中A点时,通过计算确定所得溶液是否为饱和溶液.(提示:20℃时,氯化钠溶解度为36克.)考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:由图象可以看出产生沉淀前消耗50g碳酸钠溶液,这是与废液中盐酸反应的碳酸钠溶液的质量,由于盐酸反应的碳酸钠溶液的质量和质量分数,根据二者反应的化学方程式可以计算出生成氯化钠的质量.由图象中可知生成沉淀的质量,然后依据碳酸钠与氯化钙反应的化学方程式可以计算出生成氯化钠的质量和反应的碳酸钠溶液质量.由两种反应生成的氯化钠的质量和除以所得溶液的质量就得到所得溶液中氯化钠的质量分数,所得溶液的质量应是反应的碳酸钠溶液总质量和混合液141.2g的和减去生成沉淀的质量和生成的二氧化碳的质量;与溶解度为36克时的溶质质量分数比较即可.
解答:解:
①设与盐酸反应时,生成氯化钠的质量为x,生成二氧化碳的质量为y.
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 117 44
50g×10.6% x y
=
,
=
x=5.85g,y=2.2g
②设与氯化钙反应时,需要碳酸钠溶液的质量为z,生成氯化钠的质量为w.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
z×10.6% 5g w
=
,
=
z=50g,w=5.85g
实际参加反应的碳酸钠溶液的质量为
50g+50g=100g
所得溶液中氯化钠的质量分数为:
×100%=5%;
20℃时,氯化钠饱和溶液的溶质质量分数是:
×100%=26.5%;
答:所得溶液为不饱和溶液.
①设与盐酸反应时,生成氯化钠的质量为x,生成二氧化碳的质量为y.
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 117 44
50g×10.6% x y
| 106 |
| 50g×10.6% |
| 117 |
| x |
| 106 |
| 50g×10.6% |
| 44 |
| y |
x=5.85g,y=2.2g
②设与氯化钙反应时,需要碳酸钠溶液的质量为z,生成氯化钠的质量为w.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
z×10.6% 5g w
| 106 |
| z×10.6% |
| 100 |
| 5g |
| 100 |
| 5g |
| 117 |
| w |
z=50g,w=5.85g
实际参加反应的碳酸钠溶液的质量为
50g+50g=100g
所得溶液中氯化钠的质量分数为:
| 5.85g+5.85g |
| 100g+141.2g-5g-2.2g |
20℃时,氯化钠饱和溶液的溶质质量分数是:
| 36g |
| 100g+36g |
答:所得溶液为不饱和溶液.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,增加了学生分析问题的思维跨度,考查了学生整合知识的能力,难度较大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
现有H2S、S、R、CuSO4四种物质,是按硫元素的化合价由低到高排列的,其中R这种物质的化学式可能是( )
| A、Na2S2O3 |
| B、Ag2SO4 |
| C、K2S |
| D、K2SO4 |
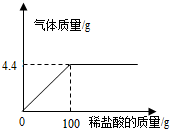 化学探究小组为测定石灰石样品中碳酸钙的质量分数,取15g样品放入烧杯,然后逐滴加入一定质量分数的盐酸反应(杂质不溶于水也不参与反应),加入的酸与生成气体的关系如下.请完成:
化学探究小组为测定石灰石样品中碳酸钙的质量分数,取15g样品放入烧杯,然后逐滴加入一定质量分数的盐酸反应(杂质不溶于水也不参与反应),加入的酸与生成气体的关系如下.请完成: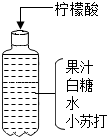 小华按如图配方自制了一瓶清凉甘甜的汽水.根据图中信息回答:
小华按如图配方自制了一瓶清凉甘甜的汽水.根据图中信息回答: