题目内容
将一块质量为8.5g的铁合金(成分为铁和碳)放入烧杯中,再向烧杯中加入91.9g稀H2SO4,恰好与铁合金中的铁完全反应(碳不溶于稀H2SO4),所得氢气的质量为0.3g.已知含碳量高于2%的铁合金为生铁,含碳量低于2%的铁合金为钢,试根据计算回答:(1)该铁合金是生铁还是钢?
(2)反应后所得溶液中溶质的质量分数是多少?
【答案】分析:(1)由生成氢气的质量和铁合金的质量,根据铁与稀硫酸反应的化学方程式可以计算出铁合金中铁的质量和生成硫酸亚铁的质量;铁合金的质量与铁的质量之差就是铁合金中碳的质量,碳的质量与铁合金的质量之比就是铁合金的含碳量.通过比较就可以知道是生铁还是钢.
(2)由铁的质量加上稀硫酸的质量去掉生成氢气的质量,就是所得溶液的质量;硫酸亚铁的质量与所得溶液的质量之比就是所得溶液中溶质的质量分数.
解答:解:设铁合金中铁的质量为x,生成硫酸亚铁的质量为y.
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.3g
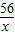 =
=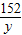 =
=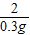
x=8.4g,y=22.8g
(1)铁合金的含碳量为
 ×100%≈1.2%<2%
×100%≈1.2%<2%
故该铁合金属于钢.
(2)反应后溶液中溶质的质量分数为
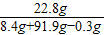 ×100%=22.8%
×100%=22.8%
答:(1)该合金是钢.
(2)反应后所得溶液中溶质的质量分数是22.8%.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.
(2)由铁的质量加上稀硫酸的质量去掉生成氢气的质量,就是所得溶液的质量;硫酸亚铁的质量与所得溶液的质量之比就是所得溶液中溶质的质量分数.
解答:解:设铁合金中铁的质量为x,生成硫酸亚铁的质量为y.
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.3g
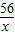 =
=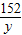 =
=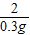
x=8.4g,y=22.8g
(1)铁合金的含碳量为
 ×100%≈1.2%<2%
×100%≈1.2%<2%故该铁合金属于钢.
(2)反应后溶液中溶质的质量分数为
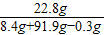 ×100%=22.8%
×100%=22.8%答:(1)该合金是钢.
(2)反应后所得溶液中溶质的质量分数是22.8%.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目