题目内容
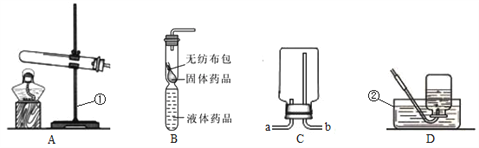
【题目】下列装置常用于实验室制取气体.根据给出的装置回答下列问题
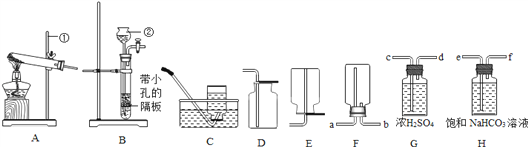
(1)指出编号仪器名称:①____________________
(2)实验室制取二氧化碳的反应原理(用化学反应方程式表示):_____,所用的发生装置和收集装置是___(从A—E装置中选择,填序号)。若改用F装置收集二氧化碳,则气体应__端进入(填“a”或“b”).制得的二氧化碳中常含有少量的氯化氢气体与水蒸气,若果用G、H装置将以上杂质气体除去,则装置正确的连接顺序是:混合气体→___(用端口字母表示).
(3)已知甲烷(CH4)是一种无色无味、密度比空气小、难溶于水的气体,实验室常用加热无水醋酸钠固体与碱石灰的混合物来制取,则实验室制取并收集甲烷应选择的装置组合为______
【答案】 长颈漏斗 。 CaCO3+2HCl=CaCl2+H2O+CO2![]() BD b efcd AE
BD b efcd AE
【解析】(1)根据实验室常用仪器可知:①长颈漏斗;(2)实验室制取二氧化碳的化学反应方程式:CaCO3+2HCl=CaCl2+H2O+CO2![]() ;此反应属于固体和液体常温下反应,发生装置选B,二氧化碳密度比空气大且能溶于水,只能用向上排空气法,收集装置是D,若改用F装置收集二氧化碳,则气体应b端进入;洗气装置中导管要长进短出,除去氯化氢气体,要用饱和碳酸氢钠溶液,干燥气体用浓硫酸,因此装置正确的连接顺序是混合气体→e→f→c→d;(3)实验室用无水醋酸钠固体和碱石灰固体混合制取甲烷需要加热,应该用A装置作为发生装置;甲烷的密度比空气小,可以用向下排空气法收集,即用C装置收集,不溶于水,可以用排水法收集,即用E装置收集。
;此反应属于固体和液体常温下反应,发生装置选B,二氧化碳密度比空气大且能溶于水,只能用向上排空气法,收集装置是D,若改用F装置收集二氧化碳,则气体应b端进入;洗气装置中导管要长进短出,除去氯化氢气体,要用饱和碳酸氢钠溶液,干燥气体用浓硫酸,因此装置正确的连接顺序是混合气体→e→f→c→d;(3)实验室用无水醋酸钠固体和碱石灰固体混合制取甲烷需要加热,应该用A装置作为发生装置;甲烷的密度比空气小,可以用向下排空气法收集,即用C装置收集,不溶于水,可以用排水法收集,即用E装置收集。

【题目】兴趣小组同学对“氢氧化钠溶液与稀硫酸混合是否发生了化学反应”进行了如下探究:
【提出问题】氢氧化钠溶液与稀硫酸混合是否发生了化学反应?
【猜想与假设】
a:二者混合发生了化学反应;
b:二者混合没有发生化学反应。
【设计并实验】
实验操作 | 实验现象 | |
甲同学 | 向盛有10mL一定溶质质量分数的氢氧化钠溶液的烧杯中,用胶头滴管慢慢滴入1-2滴稀硫酸,振荡,同时测定溶液的pH | 溶液pH减小但仍大于7 |
乙同学 | 向盛有10mL一定溶质质量分数的氢氧化钠溶液的烧杯中,先滴入几滴无色酚酞试液,然后再加入稀硫酸 | 溶液由红色变为无色 |
【得出结论】氢氧化钠溶液与稀硫酸发生了化学反应。
(1)乙同学认为甲的实验设计不合理,原因是_____________,改进的方法是____________;根据改进后的实验现象说明二者混合后发生了化学反应,写出氢氧化钠溶液与稀硫酸反应的化学方程式__________;甲同学也认为乙的实验设计也不合理,你是否赞同,说出你的理由___________。
【思考与交流】
丙同学在绝热装置中,向分别盛有10mL10%氢氧化钠溶液加入不同体积某浓度的稀硫酸,充分混合后溶液的温度变化曲线如图(混合前稀硫酸和氢氧化钠溶液均为18℃)。
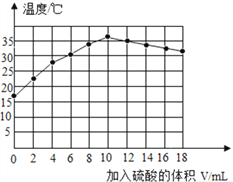
(2)根据图示分析,稀硫酸和氢氧化钠的反应是__________(填吸热、放热)反应,加入稀硫酸_________mL时,二者恰好完全反应.
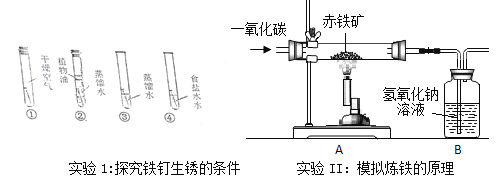
【题目】课堂上,老师取20g蔗糖放入不烧杯中,加少量水使它润湿,注入10mL浓硫酸,搅拌,同学们看到蔗糖先变黑后“发酵”形成“黑面包”,同时还闻到了刺激性气味,同学们判断黑色固体是碳,原因是浓硫酸具有强_____.
形成“黑面包”的主要原因是什么?在老师的指导下,同学们开展了探究活动.
【猜想与假设】浓硫酸与碳反应,生成大量气体使黑色固体膨胀.
【查阅资料】
Ⅰ.浓硫酸与碳在加热条件下反应,生成物中有SO2、CO2两种气体.
Ⅱ.SO2是一种具有刺激性气味的气体,能与Ca(OH)2溶液反应生成白色沉淀.
Ⅲ.SO2能使品红溶液褪色,而CO2不能.
【实验探究】
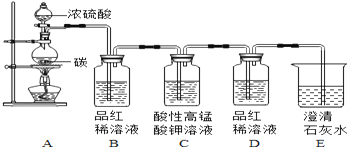
为验证碳与浓硫酸在加热条件下生成的气体产物,同学们在老师指导下设计并进行如图实验:
【事实与结论】
(1)请将能得出对应结论的实验现象填入表中。
验证气体 | 实验现象 | 实验结论 |
SO2 | __________________ | 有SO2产生 |
CO2 | ____________________ | 有CO2产生 |
(2)二氧化硫与澄清石灰水反应的化学方程式是_____________。
(3)浓硫酸与碳在加热条件下产生大量的SO2和CO2,使黑色固体膨胀,形成“黑面包”,猜想成立。
【反思与交流】
(1)小明同学提出,因老师的演示实验没有进行加热,所以同学们的探究实验无意义,其他同学一致否定了他的说法,理由是_________。
(2)若B、E中试剂交换,______(填“能”或“不能”)得出有CO2产生的结论,理由是_______________________。
(3)C中酸性高锰酸钾溶液的作用是______________.