题目内容
28.构皮滩电站是西电东送的标志性工程,电站建设正在紧锣密鼓地进行,百年大计,质量第一.某中学的初三学生在一次社会实践活动中,为了检验所用钢材是否合格,他们到钢材下料场的电锯下获取一包钢材粉末样品.回到实验室,同学们进行了分组实验,实验数据记录如下表:(烧杯的质量为25.4g,计算结果精确到0.1%)| 第一组 | 第二组 | 第三组 | |
| 烧杯+稀硫酸 | 200g | 150g | 150g |
| 加入的铁样品 | 8.5g | 8.5g | 13.5g |
| 充分反应后,烧杯+剩余物 | 208.2g | 158.2g | 163.2g |
(1)钢材含碳量的范围是______.
(2)哪一组所取的铁样品和稀硫酸恰好完全反应?
(3)假设杂质全部为碳,请通过计算说明这批钢材是否合格?
(4)试计算恰好完全反应后所得溶液中溶质的质量分数?
【答案】分析:(1)根据钢的含碳量回答.
(2)根据反应前物质的总质量和反应后烧杯中剩余物质的质量差判断生成氢气的质量,再根据氢气的质量是否变化判断硫酸是否完全反应.
(3)根据生成氢气的质量求样品中铁的质量,再求出碳的质量,最后求出碳的质量分数,从而判断是否合格.
(4)根据生成氢气的质量求生成的氯化亚铁的质量,再根据质量守恒定律求反应后溶液的质量,最后求出溶质质量分数.
解答:解:(1)钢的含碳量为0.03%~2%.
(2)第一组生成氢气的质量为200g+8.5g-208.2g=0.3g,第二组生成氢气的质量为150g+8.5g-158.2g=0.3g,第三组生成氢气的质量为150g+13.5g-163.2g=0.3g,由一、二组知,一组硫酸过量,由二、三组知,三组硫酸不足,所以第二组所取的铁样品和稀硫酸恰好完全反应.
(3)解:设8.5g样品中铁的质量为X
Fe+H2SO4═FeSO4+H2↑
56 152 2
X Y 0.3g
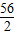 =
=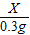
X=8.4g
8.5g-8.4g=0.1g
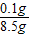 ×100%=1.2%
×100%=1.2%
1.2%<2% 钢材合格
(4)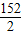 =
=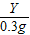
Y=22.8g
158.2g-25.4g=132.8g
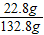 ×100%=17.2%
×100%=17.2%
答:恰好完全反应后所得溶液中溶质的质量分数为17.2%.
故答案为:(1)0.03%~2%;(2)第二组;(3)含碳量为:1.2%<2% 钢材合格;(4)17.2%.
点评:化学方程式与溶液的溶质质量分数相结合的计算是中考热点,每年必考,要学会溶质的判断,来源的分析,根据质量守恒定律求溶液质量的方法.
(2)根据反应前物质的总质量和反应后烧杯中剩余物质的质量差判断生成氢气的质量,再根据氢气的质量是否变化判断硫酸是否完全反应.
(3)根据生成氢气的质量求样品中铁的质量,再求出碳的质量,最后求出碳的质量分数,从而判断是否合格.
(4)根据生成氢气的质量求生成的氯化亚铁的质量,再根据质量守恒定律求反应后溶液的质量,最后求出溶质质量分数.
解答:解:(1)钢的含碳量为0.03%~2%.
(2)第一组生成氢气的质量为200g+8.5g-208.2g=0.3g,第二组生成氢气的质量为150g+8.5g-158.2g=0.3g,第三组生成氢气的质量为150g+13.5g-163.2g=0.3g,由一、二组知,一组硫酸过量,由二、三组知,三组硫酸不足,所以第二组所取的铁样品和稀硫酸恰好完全反应.
(3)解:设8.5g样品中铁的质量为X
Fe+H2SO4═FeSO4+H2↑
56 152 2
X Y 0.3g
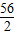 =
=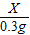
X=8.4g
8.5g-8.4g=0.1g
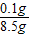 ×100%=1.2%
×100%=1.2% 1.2%<2% 钢材合格
(4)
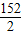 =
=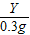
Y=22.8g
158.2g-25.4g=132.8g
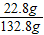 ×100%=17.2%
×100%=17.2% 答:恰好完全反应后所得溶液中溶质的质量分数为17.2%.
故答案为:(1)0.03%~2%;(2)第二组;(3)含碳量为:1.2%<2% 钢材合格;(4)17.2%.
点评:化学方程式与溶液的溶质质量分数相结合的计算是中考热点,每年必考,要学会溶质的判断,来源的分析,根据质量守恒定律求溶液质量的方法.

练习册系列答案
相关题目
构皮滩电站是西电东送的标志性工程,电站建设正在紧锣密鼓地进行,百年大计,质量第一.某中学的初三学生在一次社会实践活动中,为了检验所用钢材是否合格,他们到钢材下料场的电锯下获取一包钢材粉末样品.回到实验室,同学们进行了分组实验,实验数据记录如下表:(烧杯的质量为25.4g,计算结果精确到0.1%)
请认真阅读上面的内容,分析所有数据,回答下列问题:
(1)钢材含碳量的范围是 .
(2)哪一组所取的铁样品和稀硫酸恰好完全反应?
(3)假设杂质全部为碳,请通过计算说明这批钢材是否合格?
(4)试计算恰好完全反应后所得溶液中溶质的质量分数?
| 第一组 | 第二组 | 第三组 | |
| 烧杯+稀硫酸 | 200g | 150g | 150g |
| 加入的铁样品 | 8.5g | 8.5g | 13.5g |
| 充分反应后,烧杯+剩余物 | 208.2g | 158.2g | 163.2g |
(1)钢材含碳量的范围是
(2)哪一组所取的铁样品和稀硫酸恰好完全反应?
(3)假设杂质全部为碳,请通过计算说明这批钢材是否合格?
(4)试计算恰好完全反应后所得溶液中溶质的质量分数?
构皮滩电站是西电东送的标志性工程,电站建设正在紧锣密鼓地进行,百年大计,质量第一.某中学的初三学生在一次社会实践活动中,为了检验所用钢材是否合格,他们到钢材下料场的电锯下获取一包钢材粉末样品.回到实验室,同学们进行了分组实验,实验数据记录如下表:(烧杯的质量为25.4g,计算结果精确到0.1%)
| 第一组 | 第二组 | 第三组 | |
| 烧杯+稀硫酸 | 200g | 150g | 150g |
| 加入的铁样品 | 8.5g | 8.5g | 13.5g |
| 充分反应后,烧杯+剩余物 | 208.2g | 158.2g | 163.2g |
(1)钢材含碳量的范围是________.
(2)哪一组所取的铁样品和稀硫酸恰好完全反应?
(3)假设杂质全部为碳,请通过计算说明这批钢材是否合格?
(4)试计算恰好完全反应后所得溶液中溶质的质量分数?