题目内容
某化学实验小组,为测定一瓶混合溶液中可能含有Na2SO4、NaCl、KNO3、Na2CO3中一种或几种物质,进行如下实验:

①操作①是
②写出产生白色沉淀B的化学方程式
③混合溶液中一定有

①操作①是
过滤
过滤
②写出产生白色沉淀B的化学方程式
Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3
Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3
;③混合溶液中一定有
Na2CO3、NaCl
Na2CO3、NaCl
,可能有KNO3
KNO3
.分析:根据题干提供的信息进行分析,硝酸钡能与硫酸钠反应生成硫酸钡沉淀,硫酸钡沉淀不溶于酸,硝酸钡能与碳酸钠反应生成碳酸钡沉淀,碳酸钡能溶于酸并产生二氧化碳气体,硝酸银溶液能与含有可溶性氯离子的物质反应生成不溶于酸的白色氯化银沉淀,据此解答即可.
解答:解:(1)经过操作①得到了沉淀和溶液,故该操作是分离不溶性固体和液体的方法,是过滤,故填:过滤;
(2)白色沉淀B完全溶解在稀盐酸中,则该沉淀是碳酸钡沉淀,碳酸钠能与硝酸钡反应生成碳酸钡沉淀和硝酸钠,故填:Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3;
(3)由于白色沉淀完全溶解,故一定不是硫酸钡沉淀,故一定不含有硫酸钠,一定含有碳酸钠;滤液中加入硝酸银溶液产生白色不溶于稀硝酸的沉淀,则一定含有氯化钠,可能含有硝酸钾,故填:Na2CO3、NaCl,KNO3.
(2)白色沉淀B完全溶解在稀盐酸中,则该沉淀是碳酸钡沉淀,碳酸钠能与硝酸钡反应生成碳酸钡沉淀和硝酸钠,故填:Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3;
(3)由于白色沉淀完全溶解,故一定不是硫酸钡沉淀,故一定不含有硫酸钠,一定含有碳酸钠;滤液中加入硝酸银溶液产生白色不溶于稀硝酸的沉淀,则一定含有氯化钠,可能含有硝酸钾,故填:Na2CO3、NaCl,KNO3.
点评:本题考查了常见物质的成分的推断,完成此题,可以依据题干提供的信息结合物质间反应的实验现象进行.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
某化学实验小组为测定生石膏的组成,即测x的值,做了如下实验,将含结晶水的硫酸钙放在坩埚中加热,加热前和加热后都进行称量,随着实验次数的增加,加热的时间不断延长.它们的实验数据理如下:
利用数据可绘制成以下图象:

(1)利用实验数据,通过计算推断生石膏的化学式.
(2)通过计算解释图象中产生AB段的原因.
| 实验顺序 (按序延长加热时间) | 固体质量/g | |
| 加热前 | 加热后 | |
| 1 | 3.44 | 3.26 |
| 2 | 3.44 | 3.12 |
| 3 | 3.44 | 2.90 |
| 4 | 3.44 | 2.90 |
| 5 | 3.44 | 2.80 |
| 6 | 3.44 | 2.78 |
| 7 | 3.44 | 2.72 |
| 8 | 3.44 | 2.72 |

(1)利用实验数据,通过计算推断生石膏的化学式.
(2)通过计算解释图象中产生AB段的原因.
某化学实验小组为测定生石膏的组成,即测x的值,做了如下实验,将含结晶水的硫酸钙放在坩埚中加热,加热前和加热后都进行称量,随着实验次数的增加,加热的时间不断延长.它们的实验数据理如下:
利用数据可绘制成以下图象:
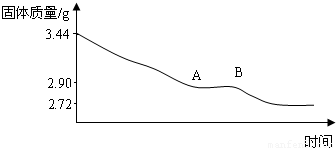
(1)利用实验数据,通过计算推断生石膏的化学式.
(2)通过计算解释图象中产生AB段的原因.
| 实验顺序 (按序延长加热时间) | 固体质量/g | |
| 加热前 | 加热后 | |
| 1 | 3.44 | 3.26 |
| 2 | 3.44 | 3.12 |
| 3 | 3.44 | 2.90 |
| 4 | 3.44 | 2.90 |
| 5 | 3.44 | 2.80 |
| 6 | 3.44 | 2.78 |
| 7 | 3.44 | 2.72 |
| 8 | 3.44 | 2.72 |

(1)利用实验数据,通过计算推断生石膏的化学式.
(2)通过计算解释图象中产生AB段的原因.
某化学实验小组为测定生石膏的组成,即测x的值,做了如下实验,将含结晶水的硫酸钙放在坩埚中加热,加热前和加热后都进行称量,随着实验次数的增加,加热的时间不断延长.它们的实验数据理如下:
利用数据可绘制成以下图象:

(1)利用实验数据,通过计算推断生石膏的化学式.
(2)通过计算解释图象中产生AB段的原因.
| 实验顺序 (按序延长加热时间) | 固体质量/g | |
| 加热前 | 加热后 | |
| 1 | 3.44 | 3.26 |
| 2 | 3.44 | 3.12 |
| 3 | 3.44 | 2.90 |
| 4 | 3.44 | 2.90 |
| 5 | 3.44 | 2.80 |
| 6 | 3.44 | 2.78 |
| 7 | 3.44 | 2.72 |
| 8 | 3.44 | 2.72 |

(1)利用实验数据,通过计算推断生石膏的化学式.
(2)通过计算解释图象中产生AB段的原因.
