题目内容
【题目】钢铁的冶炼是人类文明的一个重要标志。图1是实验室模拟炼铁的装置图。
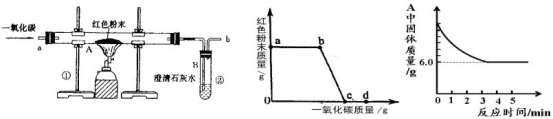
图1 图2 图3
(1)写出图1中A处发生的化学反应方程式: ;
(2)实验过程中通入![]() 质量与红色粉末质量的关系如图2所示。根据图示,下列说法不正确的是 ;(填序号)
质量与红色粉末质量的关系如图2所示。根据图示,下列说法不正确的是 ;(填序号)
①a点表示开始通入![]() ,反应开始发生
,反应开始发生
②b点表示通入![]() 一段时间后加热,反应开始发生
一段时间后加热,反应开始发生
③c点表示红色粉末已充分参加反应
④d点表示反应结束后仍需继续通入![]()
⑤可根据通入![]() 的质量计算出红色粉末的质量
的质量计算出红色粉末的质量
(3)图1装置中的不足之处是 。
(4)该实验炼制的铁与工业炼制出的铁最大的区别是 。
(5)某化学小组的同学利用上述实验对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们取了7.6![]() 固体样品,用图1所示的装置重新实验,测定的部分数据如图3所示,则原样品中铁元素与氧元素的质量比是 。
固体样品,用图1所示的装置重新实验,测定的部分数据如图3所示,则原样品中铁元素与氧元素的质量比是 。
【答案】Fe2O3+3CO![]() 2Fe+3CO2 ①⑤ 没有尾气处理装置
2Fe+3CO2 ①⑤ 没有尾气处理装置
实验室炼铁为纯净物,工业炼铁为混合物 15:4
【解析】
试题分析:(1)红色粉末是氧化铁,氧化铁和一氧化碳在高温条件下生成铁和二氧化碳,
(2)实验开始先通入一氧化碳,排尽试管内空气,防止加热发生爆炸,反应完成要继续通一氧化碳,防止生成的铁被氧化,此两步一氧化碳都未发生反应,所以不能根据通入一氧化碳的质量 进行计算,a-b红色粉末的质量未变,说明反应尚未开始;故选①⑤;
(3)一氧化碳有毒,未发生反应的一氧化碳要进行处理,图中缺乏尾气处理装置;
(4)工业炼制的是生铁,含有一定量的碳,此处炼制的是纯铁,二者一个是纯净物,一个是混合物;
故答案为:该实验炼制的铁是纯净物,工业炼制的生铁是混合物,含有一定量的碳;
(5)一氧化碳与氧化铁反应生成铁和二氧化碳,所以玻璃管固体减少的质量是氧化铁中氧元素的质量.
设氧化铁的质量为x.3CO+ Fe2O3 ![]() 2Fe + 3CO2固体减少的质量
2Fe + 3CO2固体减少的质量
160 112 160-112=48
x 7.6g-6g
160/x=48/1.6g
x=16/3g
所以样品中铁粉的质量是7.6g-5.3g=2.3g
样品中Fe元素总质量:2.3g +5.3g×(112/160) ×100%=6g
O元素总质量:5.3g×(48/160) ×100%=1.6g
所以样品中铁元素与氧元素的质量比是:6g:1.6g=15:4