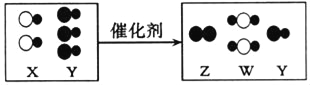
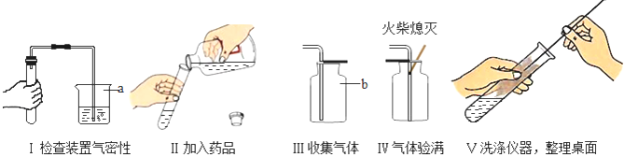
题目内容
【题目】取一种可燃物6.4克充分燃烧,测得生成二氧化碳8.8克,水7.2克。试求:
(1)该可燃物含有的元素各占多少克?____________________________
(2)可燃物的相对分子质量为32,通过计算,写出该可燃物的化学式_______________。
【答案】含碳元素2.4g,氢元素0.8g,氧元素3.2gCH4O
【解析】
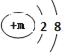
(1)根据质量守恒定律可知,该可燃物中所含碳元素的质量等于反应生成的二氧化碳中碳元素的质量=8.8g×(![]() ×100%)=2.4g;该可燃物中所含氢元素的质量等于反应生成的水中氢元素的质量==7.2g×(
×100%)=2.4g;该可燃物中所含氢元素的质量等于反应生成的水中氢元素的质量==7.2g×(![]() ×100%)=0.8g。因为2.4g+0.8g<6.4g,所以该可燃物中一定含有氧元素,且氧元素的质量=6.4g﹣2.4g-0.8g=3.2g。故该可燃物中含碳元素2.4g,氢元素0.8g,氧元素3.2g。
×100%)=0.8g。因为2.4g+0.8g<6.4g,所以该可燃物中一定含有氧元素,且氧元素的质量=6.4g﹣2.4g-0.8g=3.2g。故该可燃物中含碳元素2.4g,氢元素0.8g,氧元素3.2g。
(2)该可燃物中C、H、O的原子个数之比为![]() =1:4:1,设该可燃物的化学式为CxH4xOx,因该可燃物的相对分子质量为32,故可得:12x+1×4x+16x=32,解得:x=1,所以该可燃物的化学式为CH4O。
=1:4:1,设该可燃物的化学式为CxH4xOx,因该可燃物的相对分子质量为32,故可得:12x+1×4x+16x=32,解得:x=1,所以该可燃物的化学式为CH4O。

练习册系列答案
相关题目