题目内容
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示,请根据图示同答下列问题.
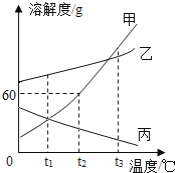
(1)t1℃甲物质和乙物质的溶解度__________(填“相等”或“不相等”)
(2)若甲物质中含有少量乙物质,提纯甲的方法是
________________________
(3)t1℃时,将甲物质的饱和溶液升温到t3℃,所得溶液中的溶质质量分数____________(填“变大”、“变小”或“不变”).
(4)t2℃时,将100g水加入到盛有30g甲物质的烧杯中,充分溶解后得到不饱和溶液,若想使溶液恰好饱和,可采用的方法是:________________
(5)t1℃时,甲、乙、丙的饱和溶液各100g,其溶质的质量关系是_______。
【答案】 不相等 降温结晶(或冷却热饱和溶液) 不变 加入30g甲/恒温蒸发50g水 乙>甲=丙
【解析】(1)据图可以看出,t1℃时,甲的溶解度小于丙的溶解度;
(2)甲的溶解度随温度升高变化明显,当甲中含有乙时,采用降温结晶的方法能将甲提纯出来;
(3)甲的饱和溶液溶解度随温度的降低而减小,t1℃时,将甲物质的饱和溶液升温到t3℃,溶液由饱和溶液变为不饱和溶液,无溶质析出,溶剂不变,故所得溶液中溶质的质量分数不变;
(4)t2℃时,甲物质的溶解度为60g,100g水中最多溶解甲物质的质量为60g;所以将30g甲物质溶于100g水得到的是不饱和溶液,若想使溶液恰好饱和,可采用的方法是增加30g甲物质或恒温蒸发50g水;
(5)t1℃时,甲、乙、丙的溶解度大小关系是乙>甲=丙,若要配制饱和溶液各100g,所需的溶剂是乙>甲=丙,其溶质的质量关系是乙>甲=丙。

【题目】某学习小组在探究碳酸钠的化学性质时,做了下面所示三个实验.
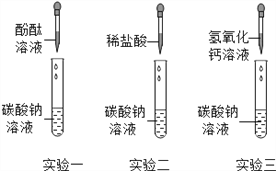
(1)实验一:探究碳酸钠溶液的酸碱性。观察到试管中溶液变为红色,可得出结论是 ________________________
实验二:探究碳酸钠与稀盐酸的反应.试管中产生大量气泡,该反应化学方程式为 _______________________。
实验三:探究碳酸钠与氢氧化钙溶液的反应.试管中产生白色沉淀,该白色沉淀为 ________
(2)小组同学将实验三试管内液体进行过滤,对滤液中溶质成分展开了探究.
【提出问题】滤液中溶质成分是什么?
【猜想】
猜想一:滤液中溶质是氢氧化钠;
猜想二:滤液中溶质是氢氧化钠、氢氧化钙和碳酸钠;
猜想三:滤液中溶质是氢氧化钠、氢氧化钙;
猜想四:滤液中溶质是______________
【讨论】大家一致认为猜想二不成立,理由是 ___________________________________。
【实验验证】
小组同学通过以下实验验证了猜想三成立,请你完成实验报告.
实验步骤 | 实验现象 | 实验结论 |
取实验三少量滤液与试管中,通入二氧化碳气体 | _______________ | 猜想三成立 |
(3)实验结束,同学对废液进行处理,将实验一、实验二溶液倒入同一洁净烧杯,得到无色溶液,则实验二试管中溶液含有溶质为 ________________。