题目内容
51、(1)给试管里的液体加热,液体的体积不要超过试管容积的
(2)下面是实验室制取气体的装置图.看图回答(填装置代号):
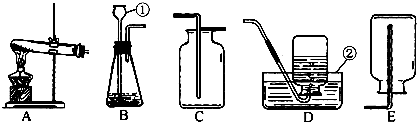
实验室制取氢气时应选用装置
(3)检验集气瓶中二氧化碳是否收集满时,应将燃着的木条放在
(4)在盛有少量稀硫酸的试管里,注入几滴氯化钡溶液,实验现象是
三分之一
,应使用酒精灯火焰的外焰
部分加热.(2)下面是实验室制取气体的装置图.看图回答(填装置代号):

实验室制取氢气时应选用装置
B
;制取氧气时应选用装置A
;制取二氧化碳时应选用装置B
.(3)检验集气瓶中二氧化碳是否收集满时,应将燃着的木条放在
集气瓶口部
.(4)在盛有少量稀硫酸的试管里,注入几滴氯化钡溶液,实验现象是
有白色沉淀产生
,反应的化学方程式为H2SO4+BaCl2=BaSO4↓+2HCl
.分析:(1)对试管里的液体加热时,液体过多容易使液体受热不均匀而出现局部沸腾,造成液体冲出试管,酒精灯的外焰温度最高,应用外焰加热;
(2)实验室制取气体的发生装置选择的依据为反应物的状态和反应的条件,收集装置的选择依据气体本身的密度、溶解性等物理性质.
(3)根据二氧化碳的性质分析判断;
(4)根据硫酸和氯化钡的反应的产物及现象分析判断.
(2)实验室制取气体的发生装置选择的依据为反应物的状态和反应的条件,收集装置的选择依据气体本身的密度、溶解性等物理性质.
(3)根据二氧化碳的性质分析判断;
(4)根据硫酸和氯化钡的反应的产物及现象分析判断.
解答:解:
(1)为防止液体冲出,实验室规定使用试管对液体加热时,管内液体体积不得超过试管容积的三分之一;酒精灯的外焰温度最高,应用外焰加热;
(2)实验室制取氢气用锌粒和稀硫酸,应选用固液型不加热的反应装置,故选B;实验室制取氧气一般用加热高锰酸钾的方法,应选固固加热型反应装置,故选A;实验室制取二氧化碳用大理石和稀盐酸,应选用固液型不加热的反应装置,故选B;
(3)二氧化碳的密度比空气大,二氧化碳不燃烧、也不支持燃烧,检验集气瓶中二氧化碳是否收集满时,应将燃着的木条放在集气瓶口部,木条熄灭证明二氧化碳收集满;
(4)硫酸和氯化钡反应,生成不溶于水、也不溶于酸的硫酸钡白色沉淀,在盛有少量稀硫酸的试管里,注入几滴氯化钡溶液,实验现象是有白色沉淀产生;其化学方程式为:H2SO4+BaCl2=BaSO4↓+2HCl;
故答案为:
(1)三分之一;外焰;
(2)B,A,B;
(3)集气瓶口部;
(4)有白色沉淀产生,H2SO4+BaCl2=BaSO4↓+2HCl.
(1)为防止液体冲出,实验室规定使用试管对液体加热时,管内液体体积不得超过试管容积的三分之一;酒精灯的外焰温度最高,应用外焰加热;
(2)实验室制取氢气用锌粒和稀硫酸,应选用固液型不加热的反应装置,故选B;实验室制取氧气一般用加热高锰酸钾的方法,应选固固加热型反应装置,故选A;实验室制取二氧化碳用大理石和稀盐酸,应选用固液型不加热的反应装置,故选B;
(3)二氧化碳的密度比空气大,二氧化碳不燃烧、也不支持燃烧,检验集气瓶中二氧化碳是否收集满时,应将燃着的木条放在集气瓶口部,木条熄灭证明二氧化碳收集满;
(4)硫酸和氯化钡反应,生成不溶于水、也不溶于酸的硫酸钡白色沉淀,在盛有少量稀硫酸的试管里,注入几滴氯化钡溶液,实验现象是有白色沉淀产生;其化学方程式为:H2SO4+BaCl2=BaSO4↓+2HCl;
故答案为:
(1)三分之一;外焰;
(2)B,A,B;
(3)集气瓶口部;
(4)有白色沉淀产生,H2SO4+BaCl2=BaSO4↓+2HCl.
点评:气体的实验室制法主要从药品、反应原理、发生装置、收集装置、检验、验满及实验操作注意事项等方面进行比较、归纳、总结实验室制取气体的一般思路和方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目