题目内容
【题目】称取NaCl和BaCl2的固体混合物32.5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如图所示.试回答下列问题:(提示:BaCl2+Na2SO4═BaSO4+↓+2NaCl) 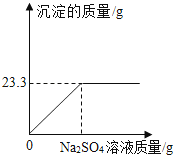
(1)完全反应后生成BaSO4沉淀g.
(2)恰好完全反应时消耗Na2SO4溶液的质量是g.
(3)恰好完全反应时所得溶液中溶质的质量分数是多少?(精确到0.1%)
【答案】
(1)23.3
(2)142
(3)
设BaCl2的质量为x,反应生成的NaCl的质量为y;恰好完全反应时消耗Na2SO4的质量为z
BaCl2+Na2SO4═BaSO4↓+2NaCl
208 142 233 117
x z 23.3g y
![]()
x=20.8g
y=11.7g
![]()
z=14.2g
恰好完全反应时消耗Na2SO4溶液的质量是 ![]() =142g
=142g
恰好完全反应后所得溶液中溶质的质量分数: ![]() ×100%=9.3%;
×100%=9.3%;
【解析】由图示可知,生成沉淀的最大量为23.3g,所以完全反应生成硫酸钡沉淀的质量为23.3g,
所以答案是:23.3;
2)设BaCl2的质量为x,反应生成的NaCl的质量为y;恰好完全反应时消耗Na2SO4的质量为z
BaCl2+Na2SO4═BaSO4↓+2NaCl
208 142 233 117
x z 23.3g y![]()
x=20.8g
y=11.7g![]()
z=14.2g
恰好完全反应时消耗Na2SO4溶液的质量是 ![]() =142g
=142g
3)恰好完全反应后所得溶液中溶质的质量分数: ![]() ×100%=9.3%;
×100%=9.3%;
(1)根据图示可以判断出生成的沉淀硫酸钡的质量;(2)设出硫酸钠溶液的质量,然后根据硫酸钡沉淀的质量及反应反应方程式计算出完全反应时消耗Na2SO4溶液的质量;(3)所得溶液中溶质的质量分数=![]() ×100%,溶质是氯化钠,包括原混合物中的氯化钠(根据沉淀的质量求出氯化钡的质量,再用混合物的质量﹣氯化钡质量)和反应生成的氯化钠(根据沉淀的质量可求出),所得溶液的质量=所加的所有物质的总质量﹣生成沉淀的质量.
×100%,溶质是氯化钠,包括原混合物中的氯化钠(根据沉淀的质量求出氯化钡的质量,再用混合物的质量﹣氯化钡质量)和反应生成的氯化钠(根据沉淀的质量可求出),所得溶液的质量=所加的所有物质的总质量﹣生成沉淀的质量.
【考点精析】利用根据化学反应方程式的计算对题目进行判断即可得到答案,需要熟知各物质间质量比=系数×相对分子质量之比.

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案