题目内容
【题目】氢氧化钠在空气中易潮解变质,小东为测定某取氢氧化钠的纯度进行如下实验。他将2.5g样品完全溶解,配成50g溶液,然后缓慢滴入稀盐酸,同时进行搅拌,使二氧化碳全部逸出。滴加过程中,多次测得溶液pH和溶液总质量,部分数据和图像如下所示:
测量次数 | 第1次 | 第6次 | 第16次 | 第21次 | 第26次 |
滴加的盐酸总质量/g | 0 | 5 | 15 | 20 | 25 |
溶液总质量/g | 50 | 55 | a | 69.78 | 74.78 |

请分析计算:
(1)第21次测量时,溶液中的溶质成分 。(写化学式)
(2)表中a= 。
(3)样品中碳酸钠的质量分数。(写出计算过程,计算结果精确到0.1%)
【答案】(1)NaCl、HCl;(2)64.78;(3)21.2%。
【解析】
(1)由题意氢氧化钠潮解变质生成碳酸钠,在样品中加入稀盐酸,氢氧化钠与盐酸反应生成氯化钠和水,碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,由pH变化图像和表格数据可知,加入稀盐酸质量为15g时,溶液的pH值恰好为7,说明氢氧化钠、碳酸钠与稀盐酸恰好完全反应,第16次测量时加入的稀盐酸为15g,说明第16次加入时样品中的氢氧化钠和碳酸钠恰好完全反应,此时的溶液中溶质只有氯化钠,继续加入稀盐酸,那么第21次测量时,溶液中的溶质成分为NaCl、 HCl;
(2)根据第(1)问的分析可知,第16次加入稀盐酸恰好完全反应,可以根据第21次的数据计算出碳酸钠反应产生的CO2的质量为50g+20g-69.78g=0.22g,则第16次加入稀盐酸后溶液的质量为50g+15g-0.22g=64.78g,则a=64.78。
(3)根据以上分析可知碳酸钠与稀盐酸反应生成二氧化碳的质量为0.22g,设2.5g样品中碳酸钠的质量为![]() ,则有:
,则有:
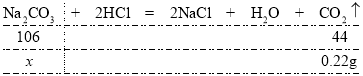
由![]() 解得
解得![]()
则2.5g样品中碳酸钠质量分数为![]()
答:样品中碳酸钠的质量分数为21.2%。

 名校课堂系列答案
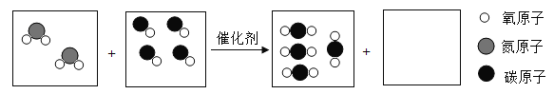
名校课堂系列答案【题目】潜水器中可使用过氧化钠(Na2O2)固体做供氧剂,过氧化钠固体与二氧化碳反应原理是:2Na2O2+2CO2═2Na2CO3+O2,为验证该反应产物,某兴趣小组进行如下实验探究。
(查阅资料)过氧化钠与水反应生成氢氧化钠和氧气。
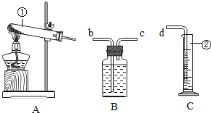
(设计实验)小组同学利用如图装置进行实(忽略稀盐酸的挥发)。
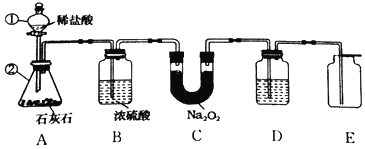
(1)装置A中标号仪器名称:①________,②________。
(2)装置A中反应的化学方程式为________。
(3)装置B的作用是________。
(4)为防止装置E收集的氧气中混有二氧化碳,装置D中盛放的试剂是________溶液。
(5)验证过氧化钠与二氧化碳反应产物
步骤 | 实验操作 | 实验现象 | 实验结论 |
① | 将带火星的木条伸入装置E中 | _____ | 产物中有氧气 |
② | 反应后取装置C中少量固体于试管中,加水完全溶解 | _____ | 固体中有未反应的过氧化钠 |
③ | 向步骤②反应后所得溶液中加入足量稀盐酸,有气体产生,将产生的气体通入足量澄清石灰水中 | _____ | 产物中有碳酸钠 |