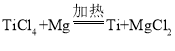题目内容
【题目】质量守恒定律的定量研究对化学科学发展具有重大意义。
(1)硅(Si)是太阳能电池和电脑芯片中不可缺少的材料。硅生产过程中的一个重要化学反应为: SiO2+2C![]() Si+2X 。由此推断X的化学式为 _______。
Si+2X 。由此推断X的化学式为 _______。
(2)下图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子:
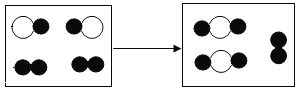
①参加反应的两种反应物的分子个数比为___________ ;
②根据该微观模拟图可以得出___________ 是化学变化中的最小粒子。
【答案】CO 2:1或1:2 原子
【解析】
(1)根据质量守恒定律的微观实质:化学反应前后,原子种类和个数不变,反应物中含有1个Si原子、2个O原子、2个C原子;生成物中含有1个Si原子,还缺少2个O原子、2个C原子,由于X前面个数是2,所以X化学式中需要含有1个O原子、1个C原子,所以化学式为CO,故填写:CO;
(2)两个黑圆圈构成的一个分子在反应物中含有两个分子,生成物中含有1个分子,所以参加反应的只有1个分子,所以参加反应的两种反应物的分子个数比为2:1或1:2,故填写:2:1或1:2;
根据化学反应的微观实质:化学反应中分子发生破裂,原子重新组合为新分子或新物质可知,原子是化学变化中的最小粒子,故填写:原子。

【题目】化学实验室开放日,小池和小航同学在药品柜中发现一瓶淡黄色粉末,瓶外贴有“过氧化钠(Na2O2)”的标签,这种外观与硫磺相似的物质到底有哪些性质?他们十分好奇,为了弄清它的有关性质,在老师的指导下,他们进行了以下探究活动:
(查阅资料]过氧化钠(Na2O2)在常温下能与水反应生成氢氧化钠和氧气;还能与二氧化碳反应生成碳酸钠和氧气,在航空航天和潜水艇中常用作供氧剂。
[设计实验](1)过氧化钠与水反应;(2)过氧化钠与二氧化碳反应。
[进行实验]
实验步骤 | 实验现象 | 结 论 |
(1)在试管中加入适量过氧化钠,再加入足量水用______________伸入试管中再向试管中加入____________ | 黄色粉末溶解,有气泡产生,木条复燃,__________ | a.产物________填“有”或“没有”)氧气 b.产物有氢氧化钠,写出过氧化钠与水反应的化学方程式: _______________ |
(2)向一定量的过氧化钠中通入适量的二氧化碳,再用实验(1)的方法进行实验,向上述充分反应后的固体产物中加入稀盐酸,将生成的气体通入____________ | 木条复燃,有气泡产生,溶液变浑浊 | a.气体产物与实验(1)相同 b.实验中_________(填“有”或“没有”)碳酸钠。生成写出碳酸钠与稀盐酸反应的化学方程式: _________________ |
[交流与讨论]
(1)通过实验,小池和小航同学知道了过氧化钠可用于航空航天和潜水艇中作为供氧剂的主要原因是__________________。
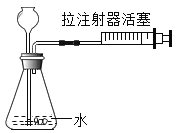
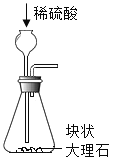
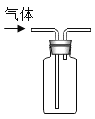
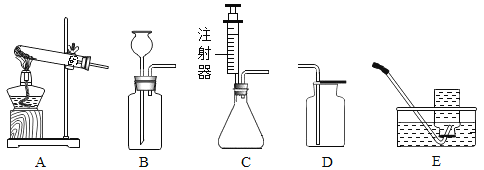
(2)实验室可用双氧水和二氧化锰制取氧气,该反应化学方程式为_______________,其发生装置和收集装置的装配,应选用的仪器有:带导管的双孔塞、玻璃片以及如图所示中的____________(填标号)等。氧气的收集方法有__________种。

(3)实验室制取气体的发生装置和收集装置类型的确定应根据____________ (填标号)
a化学药品的状态 b发生化学反应的条件 c生成气体的密度和在水中的溶解性
(4)实验室选用上述仪器还可用来制取的气体有____________(写一种)。