题目内容
(2008?怀化)下表是某反应在T1和T2时刻(T2>T1)测得的有关数据:
(1)经分析判断,这一反应类型是
(2)写出一例与上述反应类型相同的化学方程式:
(3)根据相对原子质量与各物质质量的变化关系,写出相应的化学方程式:
| 物质 | A | B | C | D |
| T1时刻质量/g | 2 | 4.8 | 19.75 | 7.45 |
| T2时刻质量/g | 2 | 9.6 | 7.5 | X |
分解
分解
反应,X=14.9
14.9
,A可能没有参加反应,也可能是该反应的催化
催化
剂.(2)写出一例与上述反应类型相同的化学方程式:
2H2O
2H2↑+O2↑
| ||
2H2O
2H2↑+O2↑
| ||
(3)根据相对原子质量与各物质质量的变化关系,写出相应的化学方程式:
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
.
| ||
| △ |
分析:(1)根据质量守恒定律,可知反应前后的物质的总质量相等,则可求x的值;通过分析个物质的质量在反应前后的质量增减情况,可推测其反应类型;
(2)已推测此反应为分解反应,则可写出与之反应类型相同的化学方程式;
(3)D增加了7.45克,B增加了4.8克,两者之比=1.552,符合加热氯酸钾制取氧气中氯化钾与氧气的质量之比.
(2)已推测此反应为分解反应,则可写出与之反应类型相同的化学方程式;
(3)D增加了7.45克,B增加了4.8克,两者之比=1.552,符合加热氯酸钾制取氧气中氯化钾与氧气的质量之比.
解答:解:(1)根据质量守恒定律,可知反应前后的物质的总质量相等,则2+4.8+19.75+7.45=2+9.6+7.5+X,则X=14.9;质量减少的为C,为反应物,质量增加的是B、D,为生成物,符合“一变多”,故为分解反应;因为A的质量不变,所以可能没有参加该化学反应,也可能为该反应的催化剂;
(2)已推测此反应为分解反应,电解水属于分解反应,化学反应方程式为2H2O
2H2↑+O2↑;
(3)D增加了7.45克,B增加了4.8克,两者之比=1.552,符合加热氯酸钾制取氧气中氯化钾与氧气的质量之比,加热氯酸钾制取氧气的化学反应方程式是2KClO3
2KCl+3O2↑;
故答为:(1)分解;14.9;催化;
(2)2H2O
2H2↑+O2↑;
(3)2KClO3
2KCl+3O2↑.
(2)已推测此反应为分解反应,电解水属于分解反应,化学反应方程式为2H2O
| ||
(3)D增加了7.45克,B增加了4.8克,两者之比=1.552,符合加热氯酸钾制取氧气中氯化钾与氧气的质量之比,加热氯酸钾制取氧气的化学反应方程式是2KClO3
| ||
| △ |
故答为:(1)分解;14.9;催化;
(2)2H2O
| ||
(3)2KClO3
| ||
| △ |
点评:本题是运用化学中的基本思想质量守恒思想,通过归纳不同物质或不同变化过程中相同点和不同点有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
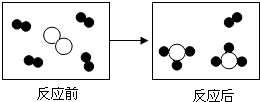 (2008?怀化)
(2008?怀化)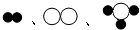 分别表示X、Y、Z三种不同的气体分子,其在一定条件下的变化如图所示:通过图示得出的下列结论中不正确的是( )
分别表示X、Y、Z三种不同的气体分子,其在一定条件下的变化如图所示:通过图示得出的下列结论中不正确的是( )