题目内容
下列各项中,前者一定大于后者的是
- A.纯铝的硬度、铝合金的硬度
- B.50℃时在100g水中溶解Ca(OH)2的质量、20℃时在100g水中溶解Ca(OH)2的质量
- C.10g镁与足量盐酸反应生成H2的质量、10g铝与足量盐酸反应生成H2的质量
- D.NaOH溶于水后溶液的温度、NH4NO3溶于水后溶液的温度
D
分析:A、根据合金的性质和金属的性质进行分析.
B、根据氢氧化钙的溶解度与温度的关系进行分析.
C、可书写出化学方程式,通过金属的质量与氢气的关系进行判断.
D、根据物质溶于水的热效应进行判断.
解答:A、合金的强度和硬度一般比组成它的纯金属更高,抗腐蚀性能等也比组成它的纯金属更好;但是,大多数合金的熔点比它的纯金属的熔点低,导电、导热性能比它的纯金属差;所以选项A错误.
B、氢氧化钙的溶解度随温度的升高而降低,所以50℃时在100g水中溶解Ca(OH)2的质量小于20℃时在100g水中溶解Ca(OH)2的质量,所以选项B错误.
C、镁、铝和盐酸反应生成氢气的质量关系为:
Mg~H2 Al~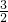 H2
H2
24g 2g 27g 3g
可发现1g镁和1g铝和盐酸充分反应生成氢气的质量为: 和
和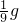 ,前者小于后者,所以选项C错误.
,前者小于后者,所以选项C错误.
D、固体氢氧化钠溶于水放出大量热量,硝酸铵溶于水要吸收热量,所以选项D正确.
故选D
点评:本题涉及到了化学中几个冷点,一是合金的硬度大于成分的硬度,熔点小于成分的熔点;二是氢氧化钙的溶解度随温度的升高而降低;三是氢氧化钠溶于水放热,硝酸铵溶于水吸热.要熟记并加以巩固.
分析:A、根据合金的性质和金属的性质进行分析.
B、根据氢氧化钙的溶解度与温度的关系进行分析.
C、可书写出化学方程式,通过金属的质量与氢气的关系进行判断.
D、根据物质溶于水的热效应进行判断.
解答:A、合金的强度和硬度一般比组成它的纯金属更高,抗腐蚀性能等也比组成它的纯金属更好;但是,大多数合金的熔点比它的纯金属的熔点低,导电、导热性能比它的纯金属差;所以选项A错误.
B、氢氧化钙的溶解度随温度的升高而降低,所以50℃时在100g水中溶解Ca(OH)2的质量小于20℃时在100g水中溶解Ca(OH)2的质量,所以选项B错误.
C、镁、铝和盐酸反应生成氢气的质量关系为:
Mg~H2 Al~
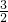 H2
H224g 2g 27g 3g
可发现1g镁和1g铝和盐酸充分反应生成氢气的质量为:
 和
和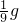 ,前者小于后者,所以选项C错误.
,前者小于后者,所以选项C错误.D、固体氢氧化钠溶于水放出大量热量,硝酸铵溶于水要吸收热量,所以选项D正确.
故选D
点评:本题涉及到了化学中几个冷点,一是合金的硬度大于成分的硬度,熔点小于成分的熔点;二是氢氧化钙的溶解度随温度的升高而降低;三是氢氧化钠溶于水放热,硝酸铵溶于水吸热.要熟记并加以巩固.

练习册系列答案
相关题目
下列各项中,前者一定大于后者的是( )
| A、纯铝的硬度、铝合金的硬度 | B、50℃时在100g水中溶解Ca(OH)2的质量、20℃时在100g水中溶解Ca(OH)2的质量 | C、10g镁与足量盐酸反应生成H2的质量、10g铝与足量盐酸反应生成H2的质量 | D、NaOH溶于水后溶液的温度、NH4NO3溶于水后溶液的温度 |