题目内容
【题目】水是生命之源,“珍惜水、节约水、保护水”是每个公民的义务和责任。
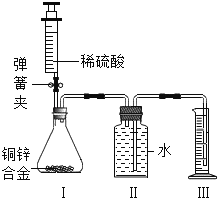
(1)我国有些村庄打深井取用地下水。检验地下水是硬水还是软水,可用的物质是_____,测定地下水的酸碱度可用_____。
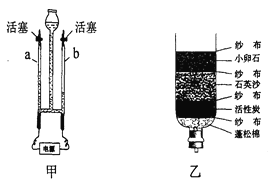
(2)有些村民取浑浊的坑水作生活用水。有同学利用所学的知识将浑浊的坑水用右图乙所示的简易净水器进行净化,其中活性炭的作用是_____,用该装置净化后的水是_____(填“混合物”或者“纯净物”)。
(3)如果地下水硬度大,会给生活和生产带来很多麻烦,生活中可以采取_____的方法,来降低其硬度。
(4)用甲装置进行电解水的实验,其化学方程式为:_____,a中收集到的气体是_____。该实验说明水是由_____组成的。
(5)请举一例生活中节约用水的具体措施_____。
【答案】肥皂水 PH试纸(合理即可) 吸附 混合物 煮沸 2H2O![]() 2H2↑+O2↑ O2 氢、氧两种元素 淘米水浇花(合理即可)
2H2↑+O2↑ O2 氢、氧两种元素 淘米水浇花(合理即可)
【解析】
(1)硬水中含有较多的可溶性钙镁化合物,与肥皂水混合有浮渣产生,软水中不含或含有少量的可溶性钙镁化合物,与肥皂水混合产生泡沫,故使用肥皂水能鉴别硬水和软水,测定地下水的酸碱度可以使用pH试纸;
(2)活性炭具有吸附性,能吸附色素和异味;净化后的水中含有可溶性杂质,属于混合物;
(3)硬水中含有的可溶性钙镁化合物受热易分解生成不溶性钙镁化合物,加热煮沸能降低水的硬度;
(4)电解水的实验,a中收集到的气体体积较少,是氧气,b端得到的气体体积大,得到的是氢气,水通电能分解生成氢气和氧气,说明是由氢元素和氧元素组成的,反应的化学方程式为:2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
(5)生活中节约用水的措施很多,例如:洗菜水浇花、洗衣水冲厕等。

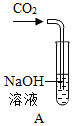
【题目】对比实验是化学研究中经常采用的方法。化学兴趣小组的同学为研究CO2通入NaOH溶液是否发生了反应,设计了下列实验。请和化学兴趣小组的同学一起探究并回答问题:
(设计与实验)
实验 | 实验步骤一 | 实验步骤二 | 实验 | 实验步骤一 | 实验步骤二 |
实验I |
|
| 实验II |
|
|
(探究与结论)
(1)实验I中步骤一发生反应的化学方程式是____________________________,步骤二产生的现象是________________。
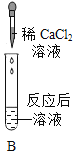
(2)实验Ⅱ中步骤二发生反应的化学方程式是____________________________。
CaCl2溶液也可以用______(填序号)代替达到实验目的。
A硝酸钡溶液 B氯化钾溶液
C碳酸钾溶液 D硫酸钠溶液
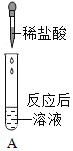
(3)实验结束后,又有同学提出可向通入足量CO2的NaOH溶液中滴加无色酚酞,判断两者是否发生反应。立马被小组同学否定,原因是____________________________。
(查阅资料)
物质 | 溶解度(s)/g |
NaOH | 17.3 |
Na2CO3 | <0.01 |
(4)同学们在查阅资料后又设计了实验Ⅲ,将CO2通入NaOH的酒精溶液,当观察到____________的现象,证明两者确实发生了反应。
【题目】将16g硫在给定量的氧气中燃烧,有如下实验数据:
实验1 | 实验2 | 实验3 | |
给定O2的质量 | 1.5g | 16g | 20g |
生成SO2质量 | 3.0g | 32g | 32g |
分析数据回答:
(1)在三次实验中,第_____次恰好完全反应;
(2)在第_____次实验中硫有剩余,剩余_____g。
(3)在第_____次实验中氧气有剩余
【题目】某校化学兴趣小组在查阅资料中发现:可燃物燃烧需要的最低氧含量数据如表:
请结合数据回答下列问题:
可燃物名称 | 蜡烛 | 木炭 | 棉花 | 红磷 | 白磷 |
最低氧含量/% | 16 | 14 | 8 | 8.8 | 3.2 |
(1)图1为教材中测量空气中氧气体积分数的实验装置图:请写出集气瓶中发生的反应的化学方程式:______结合数据,你认为红磷适合于测量空气中氧气的体积分数吗?你的理由是:______。但实验过程中又确实看到进来的水的体积约占集气瓶内容积的![]() .其原因可能是:______。
.其原因可能是:______。
(2)图2是拉瓦锡的实验装置,回看拉瓦锡的实验选择汞的优点有:______(不定项选择)
A.实验过程没有污染
B.在汞槽中起到液封作用
C.生成的化合物加热分解后又得到汞和氧气
D.能将密闭装置内空气中的氧气几乎耗尽
(3)请你结合数据设计一个实验证明密闭装置内红磷熄灭后的空气中还有氧气,写出操作步骤和现象:______。
(4)已知当氧气浓度为10%﹣14%时,人仍有意识,但会出现判断失误,且本身不察觉。当氧气浓度为6%﹣8%时,人会呼吸停止,并在68分钟内死亡。所以为进入某储藏蔬菜的地窖,一般都会进行灯火实验,结合数据分析使用蜡烛做灯火实验可靠吗?并说明理由:______。