题目内容
【题目】氨对工业及国防具有重要意义,下图为某化学小组同学模拟工业合成氨原理设计如图实验.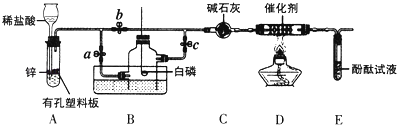
完成以下实验中相关问题:
检查装置气密性.
(1)关闭ac,打开b,从长颈漏斗中加入稀盐酸,A中发生反应生成氢气的化学方程式为 , 在E出口处收集H2并验纯.
(2)关闭a、b、c在盛满空气的多孔玻璃钟罩内用激光点燃足量白磷,此操作的目的是 .
(3)待多孔玻璃钟罩冷却到室温,先打开a,再加热D处的酒精灯,最后打开止水夹 , H2、N2在催化剂的作用下生成NH3 , 该反应的化学方程式为 . 实验过程中C装置的作用是 , E装置的现象为 , 此现象说明NH3溶于水后溶液呈性.
(4)实验室用固体Ca(OH)2和固体NH4Cl混合在加热条件下制NH3 , 应选用如图哪个装置(填“A”或“B”),该反应的化学方程式为 . 
【答案】
(1)Zn+2HCl=ZnCl2+H2↑
(2)除去空气中的氧气得到较纯净的氮气
(3)c;N2+3H2![]() 2NH3;除去水蒸气;酚酞试液变红;碱
2NH3;除去水蒸气;酚酞试液变红;碱
(4)B;Ca(OH)2+2NH4Cl ![]() CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
【解析】①锌和稀盐酸反应生成氯化锌和氢气,故填:Zn+2HCl=ZnCl2+H2↑;②生成氨气的原料之一为氮气,在玻璃钟罩中点燃白磷消耗掉钟罩内的氧气,剩下的就是比较纯净的氨气,故填:除去空气中的氧气得到较纯净的氮气;(3由题意要让氮气和氢气的混合气体进入D装置进行反应,故要打开止水夹c,氮气和氢气在加热条件和有催化剂时生成氨气,据此书写化学方程式;碱石灰有吸水性,故C装置的作用是除去水蒸气;生成的氨气遇水生成碱可以使无色酚酞试液变红,由此也说明了氨气溶于水生溶液呈碱性,故填:c;N2+3H2![]() 2NH3;除去水蒸气;酚酞试液变红;碱;(4)根据实验室制取氨气用的是固体药品反应条件是加热,所以选择B装置来进行反应,根据复分解反应的特点书写化学方程式,故填:B;Ca(OH)2+2NH4Cl
2NH3;除去水蒸气;酚酞试液变红;碱;(4)根据实验室制取氨气用的是固体药品反应条件是加热,所以选择B装置来进行反应,根据复分解反应的特点书写化学方程式,故填:B;Ca(OH)2+2NH4Cl ![]() CaCl2+2H2O+2NH3↑.
CaCl2+2H2O+2NH3↑.
【考点精析】认真审题,首先需要了解氢气的制取和检验(氢气的实验室制法原理:Zn + H2SO4 = ZnSO4 +H2↑;Zn + 2HCl = ZnCl2 +H2↑不可用浓盐酸的原因 浓盐酸有强挥发性 ;不可用浓硫酸或硝酸的原因 浓硫酸和硝酸有强氧化性),还要掌握书写化学方程式、文字表达式、电离方程式(注意:a、配平 b、条件 c、箭号)的相关知识才是答题的关键.