题目内容
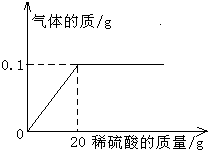 某研究性学习小组为测定铜锌合金中铜的质量分数,进行如下实验:取合金10g,向其中不断加入稀硫酸,产生的气体与所加稀硫酸的质量关系如图所示,求:
某研究性学习小组为测定铜锌合金中铜的质量分数,进行如下实验:取合金10g,向其中不断加入稀硫酸,产生的气体与所加稀硫酸的质量关系如图所示,求:(1)恰好完全反应时生成氢气的质量为
(2)合金中铜的质量分数是多少?
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)由图示可知氢气的质量;
(2)根据方程式和氢气的质量可以求得参加反应的锌的质量,进而计算出样品中铜的质量分数.
(2)根据方程式和氢气的质量可以求得参加反应的锌的质量,进而计算出样品中铜的质量分数.
解答:解:(1)由图示可知氢气的质量为0.1g;
故答案为:0.1;
(2)设合金中锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.1g
=
x=3.25g
合金中铜的质量为:10g-3.25g=6.75g
则合金中铜的质量分数为:
×100%=67.5%
答:合金中铜的质量分数为67.5%.
故答案为:0.1;
(2)设合金中锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.1g
| 65 |
| 2 |
| x |
| 0.1g |
x=3.25g
合金中铜的质量为:10g-3.25g=6.75g
则合金中铜的质量分数为:
| 6.75g |
| 10g |
答:合金中铜的质量分数为67.5%.
点评:本题主要考查有关化学方程式的计算和质量分数的计算,难度不大.从图象中得到“当加入20g稀硫酸时,合金中的锌恰好反应完全,产生0.1g氢气”的信息是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
生活中发生缓慢氧化的实例很多,下列过程中不涉及缓慢氧化的是( )
| A、酒和醋的酿造 |
| B、人在长跑时急促呼吸 |
| C、农家肥的腐熟 |
| D、酒精灯安静燃烧 |