题目内容
【题目】根据下图装置回答问题。
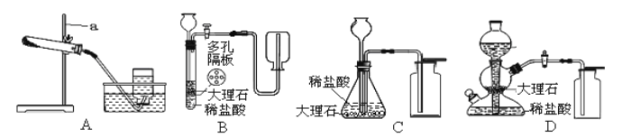
①仪器“a”的名称是 .
②用装置A进行氯酸钾分解制取氧气的实验,还需补充的仪器是 ,化学方程式为 。
③在A-D的发生装置部分,能随时控制反应发生和停止的是 (填字母,下同),适合于实验室制取二氧化碳的装置是 ,二氧化碳气体的验满方法是 。
④用双氧水与二氧化锰的混合物制取氧气能否使用装置D?理由是 。
⑤现取一定质量的石灰石与足量稀盐酸充分反应,生成0.2mol二氧化碳。请计算:
Ⅰ.参加反应的碳酸钙的物质的量(根据化学方程式进行计算)
Ⅱ.上述实验中所取石灰石的质量可能为 (填字母)。
A.16.0g B.20.0g C.24.0g D.26.0g
【答案】①铁架台;②酒精灯;![]() ;③BD;CD;把燃着的木条放在集气瓶口,看是否复燃;④不能;二氧化锰是黑色粉末,不能达到固液分离的目的;⑤0.2mol;CD.
;③BD;CD;把燃着的木条放在集气瓶口,看是否复燃;④不能;二氧化锰是黑色粉末,不能达到固液分离的目的;⑤0.2mol;CD.
【解析】①仪器“a”的名称是铁架台;②用装置A进行氯酸钾分解制取氧气的实验,还需补充的仪器是酒精灯,化学方程式为![]() ;③在A-D的发生装置部分,BD装置通过调节活塞可以控制反应发生和停止,实验室制取二氧化碳常用石灰石和稀盐酸在常温下反应制取气体,二氧化碳的密度比空气大,故其发生的装置可以是C、D,二氧化碳气体不能燃烧也不支持燃烧,所以二氧化碳的验满方法是把燃着的木条放在集气瓶口,看是否复燃; ④用双氧水与二氧化锰的混合物制取氧气,因为二氧化锰是黑色粉末,不能达到固液分离的目的,所以不能使用装置D;⑤现取一定质量的石灰石与足量稀盐酸充分反应,生成0.2mol二氧化碳,设参加反应的碳酸钙的物质的量为x,
;③在A-D的发生装置部分,BD装置通过调节活塞可以控制反应发生和停止,实验室制取二氧化碳常用石灰石和稀盐酸在常温下反应制取气体,二氧化碳的密度比空气大,故其发生的装置可以是C、D,二氧化碳气体不能燃烧也不支持燃烧,所以二氧化碳的验满方法是把燃着的木条放在集气瓶口,看是否复燃; ④用双氧水与二氧化锰的混合物制取氧气,因为二氧化锰是黑色粉末,不能达到固液分离的目的,所以不能使用装置D;⑤现取一定质量的石灰石与足量稀盐酸充分反应,生成0.2mol二氧化碳,设参加反应的碳酸钙的物质的量为x,
![]()
1 1
X 0.2mol
![]()
x=0.2mol
因为碳酸钙的摩尔质量为100g/mol,所以碳酸钙的质量为:100g/mol×0.2mol=20g,所以实验中所取石灰石的质量可能是24g、26g,故C、D符合题意.
试题分析:①根据仪器书写名称;②根据氯酸钾在二氧化锰催化剂和加热条件下生成氧气和氯化钾书写方程式,并需要酒精灯加热;③根据实验室用大理石和稀盐酸制取二氧化碳,属于固-液常温型,适用的装置且能控制反应速率的是启普发生器,检验二氧化碳收集满的方法是将燃着的木条放在集气瓶口观察现象;④根据二氧化锰是粉末状分析;⑤g根据生成二氧化碳的物质的量,利用方程式计算碳酸钙的物质的量,结合摩尔质量换算成质量解答.
考点:实验室制取氧气的方法、反应原理、仪器装置的选择,方程式的书写方法;二氧化碳的性质及验满方法;根据方程式的相关计算