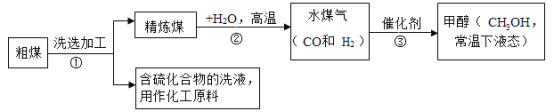
题目内容
【题目】下列说法正确的是
A.质量相等的硫酸钙和碳酸钙中氧元素的质量比为51:50
B.消耗等质量的氧气,硫与碳的质量比不一定是8:3
C.硝酸铵和氯化钾的混合物中氮元素质量分数为21%,该混合物中硝酸铵的质量分数为45%
D.质量和质量分数均相等的氢氧化钠溶液和稀硫酸,充分混合后,向所得溶液中滴加氢氧化钡溶液,不会出现白色沉淀
【答案】B
【解析】
A、设CaSO4和CaCO3的质量为m,则根据题意有: ![]() ;故选项错误;
;故选项错误;
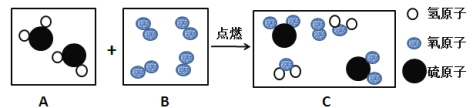
B、假设消耗O2的质量为32份质量,则有
①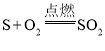
反应中硫和氧气的质量比为32: 32
②
反应中碳和氧气的质量比为12: 32
③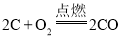 (氧气不足)
(氧气不足)
反应中碳和氧气的质量比为24: 32
对比反应①②可知,当碳在氧气中完全燃烧时,消耗等质量的O2所用硫、碳的质量比为32:12=8:3;对比反应①③可知,当碳在氧气不足时燃烧,消耗等质量的O2所用硫、碳的质量比为32:24=4:3(或8:6)。所以消耗等质量的氧气,硫和碳的质量比不一定是8:3,准确的比例关系应该为8:3到4:3之间;故选项正确;
C、假设硝酸铵和氯化钾混合物的质量为100 g,那么N元素的质量为![]() ,设硝酸铵的质量为x,一个硝酸铵分子中有2个氮原子,那么
,设硝酸铵的质量为x,一个硝酸铵分子中有2个氮原子,那么![]() ,
,![]() ,x=60g,则混合物中硝酸铵的质量分数为
,x=60g,则混合物中硝酸铵的质量分数为![]() ;故选项错误;
;故选项错误;
D、根据反应的化学方程式![]() 可知,无论反应后哪种物质有剩余,生成物中有Na2SO4 ,加入的Ba(OH)2溶液会与其反应,生成白色沉淀;故选项错误。
可知,无论反应后哪种物质有剩余,生成物中有Na2SO4 ,加入的Ba(OH)2溶液会与其反应,生成白色沉淀;故选项错误。
故选:B。

【题目】乙醇俗称酒精,是一种有机物,分子式为C2H5OH,在汽油中加入适量乙醇作为汽车燃料,可以节省石油资源并适当减少汽车的尾气污染。某同学为了探究一定量乙醇在空气中燃烧的产物进行了如下探究:
[提出问题]乙醇燃烧的产物是什么? .
[猜想假设]猜想1:含有H2O、CO2;猜想2:含有 H2O、CO;猜想3:含有________________。
[设计实验](1)小明同学点燃刚加入纯净酒精的酒精灯,将干冷的烧杯罩在酒精的火焰上方,观察到_____________,证明有水生成。
(2)小明再将涂有饱和石灰水的小烧杯罩在火焰上方,观察到石灰水变浑浊,证明猜想2不成立。
[交流讨论]小芳同学认为[设计实验](2)中石灰水变浑浊不一定生成碳酸钙,还可能的原因是_______________。
[继续探究]小芳为探究乙醇燃烧的生成物除了水之外,还有什么物质,她将4.6g乙醇和8 g氧气置于完全密闭的容器中引燃,恰好完全反应后依次通入如图所示装置中(假设装置气密性良好,各装置的吸收剂足量) ,并称得反应前后各装置的质量,如下表:
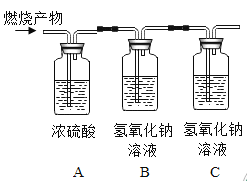
装置 | A装置 | B装置 | C装置 |
通入前的质量/g | 30 | 30 | 30 |
通入后的质量/g | 35.4 | 34.4 | 30.2 |
(1)C装置的作用是______________。
(2)根据以上数据可推测出猜想_____________成立。