题目内容
某小组同学为探究二氧化锰对过氧化氢分解速度的影响,设计了以下实验:
(1)完善实验一、实验二:
实验步骤 | 实验现象 | 实验结论 | |
实验一 |
| 带火星的木条不复燃 | 过氧化氢分解的速率较慢 |
实验二 |
| ___________ | ________ |
(2)实验三:待实验二结束,剩余的液体化学式为_____,倒出多余液体,继续向其中加入5%的过氧化氢溶液,实验现象为____________,得出结论__________,写出此时的反应方程式__________;
(3)实验四,实验之前称量加入二氧化锰的质量为m1,待实验三结束后,取出二氧化锰,干燥后称量质量为m2,则m1_____m2(填“>”、“<”、“=”),得出结论___________,从液体中取出二氧化锰的操作名称为______;
除去下列物质中混有的杂质,所选用的方法或试剂不正确的是( )
选项 | 物质 | 杂质 | 方法或试剂 |
A | N2 | O2 | 灼热的铜网 |
B | Fe | Cu | 稀盐酸 |
C | NaCl | KNO3 | 蒸发结晶,趁热过滤 |
D | FeCl2 | CuCl2 | 足量铁粉,过滤 |
A. A B. B C. C D. D
为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数,进行如下实验:
①取200g混合溶液加入足量的AgNO3溶液,经过滤、洗涤、干燥、称量,得到143.5gAgCl固体;②另取原混合溶液各200g与含有杂质的废铁屑反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
实验组别 | 一 | 二 | 三 | 四 | 五 |
混合溶液质量/g | 200 | 200 | 200 | 200 | 200 |
铁屑质量/g | 6 | 9 | 12 | 15 | 18 |
析出铜的质量/g | 6.4 | 9.6 | m | 16 | 16 |
请分析计算:
(1)表中第三组实验的m值为_______。
(2)第_____组实验恰好完全反应。
(3)铁屑中铁的质量分数为多少___________? (计算结果精确到0.1%)
(4)原混合溶液中FeCl2 的质量分数为多少______________? (计算结果精确到0.1%)




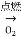 H2O
H2O H2SO4
H2SO4 Ca(NO3)2
Ca(NO3)2 CaCO3
CaCO3 CuSO4
CuSO4 CuCl2
CuCl2 NaOH
NaOH NaNO3
NaNO3 B.
B.  C.
C.  D.
D. 
 分离少量泥沙和水 B.
分离少量泥沙和水 B.  装置气密性良好
装置气密性良好 作反应容器 D.
作反应容器 D.  滴管用完放回原滴瓶
滴管用完放回原滴瓶
