题目内容
【题目】有NaHCO3和Na2CO3混合物13.7g,将其充分加热至固体质量不再减少,得剩余固体.将产生的气体通入足量的Ca(OH)2溶液中,产生5.0g沉淀.下列说法正确的是( )
A. 剩余固体为混合物
B. 剩余固体的质量为11.5g
C. 原混合物中Na2CO3的质量大于NaHCO3
D. 将剩余固体溶于足量的稀盐酸,产生4.4g CO2
【答案】D
【解析】
设生成5.0g沉淀需要二氧化碳的质量为x,则:
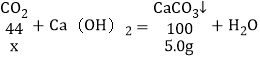
![]()
x=2.2g,
设碳酸氢钠分解生成2.2g二氧化碳需要参加反应的碳酸氢钠的质量为y,同时生成碳酸钠质量为z则:
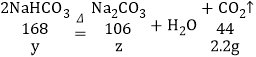
![]() y=8.4g;
y=8.4g;
![]() z=5.3g,所以原来碳酸钠质量:13.7g﹣8.4g=5.3g;
z=5.3g,所以原来碳酸钠质量:13.7g﹣8.4g=5.3g;
A、剩余固体是碳酸钠,属于纯净物,故A错;
B、剩余固体的质量为:5.3g+5.3g=10.6g,故B错;
C、原混合物中Na2CO3质量为5.3g,碳酸氢钠的质量为8.4g,故C错;
D、剩余固体质量为:5.3g+5.3g=10.6g,设10.6g碳酸钠与盐酸反应生成二氧化碳质量为k则:
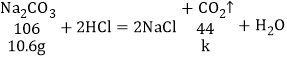
![]()
k=4.4g,故D正确。
故选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
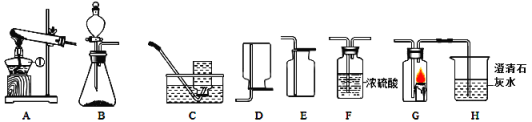
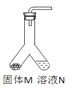
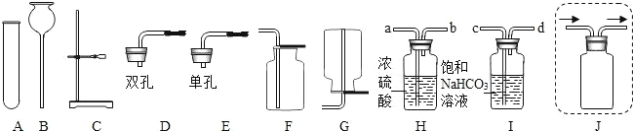
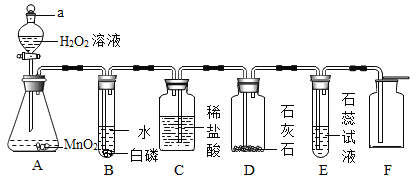
【题目】表中的装置制取气体(制取时将装置中的固体与液体混合)。下表为气体的制取的装置和反应的化学方程式
制取气体的装置 | 固体M | 溶液N | 制取的气体 | 反应的化学方程式 |
| 大理石 | _______。 | CO2 | __________; |
锌粒 | 稀硫酸 | ________; | __________; |