题目内容
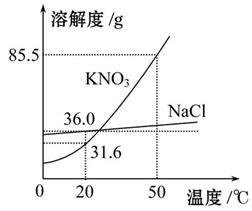
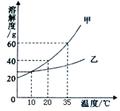
如图为NaCl、KNO3的溶解度曲线(水的密度约为1 g·cm-3)。
(1)20 ℃时,KNO3的溶解度是 g,以下实验中:
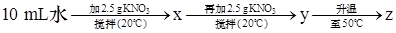
x、y、z中为饱和溶液的是 。
(2)若使NaCl溶液由不饱和变为饱和溶液,一般采用的方法是 或 。
(3)除去KNO3固体中混有的少量NaCl,提纯的步骤是:加水溶解、 、 ,然后过滤、洗涤、干燥。
(1)20 ℃时,KNO3的溶解度是 g,以下实验中:
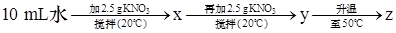

x、y、z中为饱和溶液的是 。
(2)若使NaCl溶液由不饱和变为饱和溶液,一般采用的方法是 或 。
(3)除去KNO3固体中混有的少量NaCl,提纯的步骤是:加水溶解、 、 ,然后过滤、洗涤、干燥。
(1)31.6 y (2)蒸发溶剂 加溶质
(3)蒸发浓缩 降温结晶
(3)蒸发浓缩 降温结晶
(1)由图中知20 ℃时KNO3的溶解度是31.6 g,那么在20 ℃时
10 mL水也就是10 g水中最多能溶解3.16 g KNO3,2.5 g<3.16 g,所以x是不饱和溶液,(2.5 g+2.5 g)="5" g>3.16 g,y是饱和溶液;50 ℃时KNO3的溶解度是85.5 g,5 g<8.55 g, z是不饱和溶液。(2)由于NaCl的溶解度受温度的影响小,可以采用蒸发溶剂或加溶质的方法使其达到饱和。(3)因为硝酸钾溶解度随温度变化比较大,NaCl的溶解度受温度的影响小,所以要用冷却热饱和溶液法,即先加水溶解,再加热蒸发浓缩制成热的饱和溶液,然后进行降温结晶,接着过滤、洗涤、干燥,就可以得到硝酸钾了。
10 mL水也就是10 g水中最多能溶解3.16 g KNO3,2.5 g<3.16 g,所以x是不饱和溶液,(2.5 g+2.5 g)="5" g>3.16 g,y是饱和溶液;50 ℃时KNO3的溶解度是85.5 g,5 g<8.55 g, z是不饱和溶液。(2)由于NaCl的溶解度受温度的影响小,可以采用蒸发溶剂或加溶质的方法使其达到饱和。(3)因为硝酸钾溶解度随温度变化比较大,NaCl的溶解度受温度的影响小,所以要用冷却热饱和溶液法,即先加水溶解,再加热蒸发浓缩制成热的饱和溶液,然后进行降温结晶,接着过滤、洗涤、干燥,就可以得到硝酸钾了。

练习册系列答案
相关题目



 ①
① 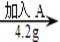 ②
②  ③
③  ④
④ ⑤
⑤