题目内容
【题目】某课外小组研究“影响 H2O2 生成 O2 反应速率的因素”的课题。通过查阅资料,提出如下猜想。
(提出猜想)催化剂和反应物浓度都会影响 H2O2 生成 O2 的反应速率。
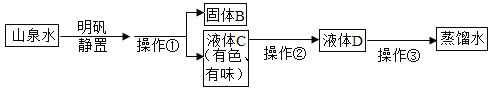
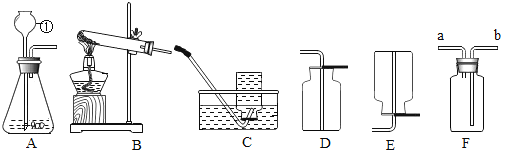
(实验过程)实验装置如图。
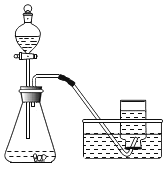
(实验操作)检查装置的气密性良好。将分液漏斗中的液体加入锥形瓶中,立即收集一瓶逸出的气体。
(实验记录)
实验编号 | Ⅰ | Ⅱ | Ⅲ |
反应物 | 5%H2O2 50mL | 5%H2O2 50mL | 3%H2O2 50 mL |
加入固体 | 0.5g CuO | 0.5g MnO2 | 0.5g MnO2 |
收集等体积O2所需时间 | 105s | 45s | 78s |
充分反应后,将实验Ⅱ中剩余物质里的 MnO2提取的方法是_____。
(实验结论)该探究过程得出的结论是_____。
(反思评价)H2O2 在常温加入 MnO2 后反应速率加快。小敏同学提出,为了更好地证明 MnO2 对 H2O2 生成O2反应速率的影响,还应该增加一组对比实验。该实验选用的药品和用量为_____。
(实验拓展)小敏同学发现用收集的气体进行铁丝燃烧实验时,没有产生明显的火星四射现象。造成这种结果的可能原因是_____。
【答案】过滤/(过滤、洗涤、干燥) 催化剂的种类和反应物H2O2的浓度都会影响反应速率 5%H2O2 50mL(不加催化剂)/3%H2O2 50mL(不加催化剂) 氧气不纯净/铁丝生锈/火材梗太长过多地消耗了瓶内氧气(合理即可)
【解析】
过氧化氢在催化剂催化作用下生成水和氧气,铁在氧气中点燃生成四氧化三铁。
[实验记录]二氧化锰不溶于水,故充分反应后,将实验Ⅱ中剩余物质里的 MnO2提取的方法是过滤/(过滤、洗涤、干燥)。
[实验结论]催化剂能加快反应速率,过氧化氢的浓度越大,反应速率越快,故该探究过程得出的结论是催化剂的种类和反应物H2O2的浓度都会影响反应速率。
[反思评价]H2O2 在常温加入 MnO2 后反应速率加快。小敏同学提出,为了更好地证明 MnO2 对 H2O2 生成O2反应速率的影响,应该设置对照实验,前面均加催化剂,则实验不加催化剂做对照,故该实验选用的药品和用量为5%H2O250mL(不加催化剂)/3%H2O250mL(不加催化剂)。
[实验拓展]氧气不纯净,铁丝生锈等均不燃烧,用收集的气体进行铁丝燃烧实验时,没有产生明显的火星四射现象,造成这种结果的可能原因是氧气不纯净/铁丝生锈/火材梗太长过多地消耗了瓶内氧气。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】小宇查阅资料得知:氯酸钾在二氧化锰、氧化铁等物质作催化剂条件下可生成氯化钾和氧气。于是,他对影响氯酸钾分解的因素及催化剂的效果产生了探究兴趣。
(提出问题)氧化铁是否比二氧化锰催化效果更好?
(设计实验)小宇以生成等体积的氧气为标准,设计了下列几组实验。
序号 | KClO3 | 其它物质的质量 | 温度 | 收集氧气的体积 | 反应时间 |
① | 10.0g | 无 | 330℃ | 100mL | t1 |
② | 10.0g | 氧化铁1.5g | 330℃ | 100mL | t2 |
③ | 10.0g | 二氧化锰1.5g | 330℃ | 100mL | t3 |
④ | 10.0g | 二氧化锰xg | 380℃ | 100mL | t4 |
(结论与反思)
(1)若t1________t2(选填“>”、“=”或“<”),说明氧化铁能加快氯酸钾的分解速率。若要确定氧化铁是氯酸钾分解反应的催化剂,还需探究反应前后氧化铁的________和________不变。
(2)若t2>t3,说明氧化铁对氯酸钾分解的催化效果比二氧化锰________(填“强”或“弱”)。
(3)写出实验④所涉及反应的化学方程式__________________。
(4)实验④中MnO2的质量x为________g,若t3 > t4,则化学反应速率与温度的关系是______________。
(5)氯酸钾的分解速率可能还与_____________________因素有关,需设计实验进一步证明。