题目内容
金属钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,将2.3g金属钠投入97.7g水中,充分反应后,所得的溶液中溶质的质量分数( )
| A.等于2.3% | B.等于4% | C.小于4% | D.大于4% |
设生成氢氧化钠的质量为x,生成氢气的质量为y.
2Na+2H2O=2NaOH+H2↑
46 80 2
2.3g x y
=
=
,x=4g,y=0.1g
所得溶液中溶质的质量分数为
×100%≈4.004%>4%
故选D.
2Na+2H2O=2NaOH+H2↑
46 80 2
2.3g x y
| 46 |
| 2.3g |
| 80 |
| x |
| 2 |
| y |
所得溶液中溶质的质量分数为
| 4g |
| 2.3g+97.7g-0.1g |
故选D.

练习册系列答案
相关题目
金属钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,将2.3g金属钠投入97.7g水中,充分反应后,所得的溶液中溶质的质量分数( )
| A、等于2.3% | B、等于4% | C、小于4% | D、大于4% |
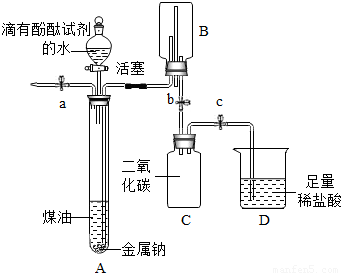 小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.
小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.【小资料】金属钠一般存放在煤油中或用石蜡封存,煤油的密度为0.8g/mL.
(1)问题:采取上述保存金属钠的方法中,煤油或石蜡的作用是______.
(2)实验过程
| 操作 | 现象及解释 | |
| ① | 打开止水夹a及分液漏斗活塞,待液体充满大试管后,关闭止水夹a及分液漏斗活塞. | 液体分层,钠熔成银白色小球,在液体分层的界面上方跳动,产生大量气泡,下层溶液变成红色,并逐渐被压入B中.金属钠的物理性质(写出一点即可)______. |
| ② | 打开止水夹b,待B中部分溶液进入C中,迅速关闭止水夹b. | 反应的化学方程式为______ |
| ③ | 打开止水夹c. | ______溶液红色消失. 反应的化学方程式为______. |
| ④ | 将燃着的木条伸到导管尖嘴处,打开止水夹a; 在火焰上方罩一个干冷的烧杯. | 气体燃烧,产生淡蓝色火焰 烧杯内壁有无色液滴生成,A中气体为氢气. |
金属钠与水反应的化学方程式为______;反应结束,C中溶液的溶质是(指示剂除外,写出所有可能)______.
 (2012?房山区二模)小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.
(2012?房山区二模)小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.